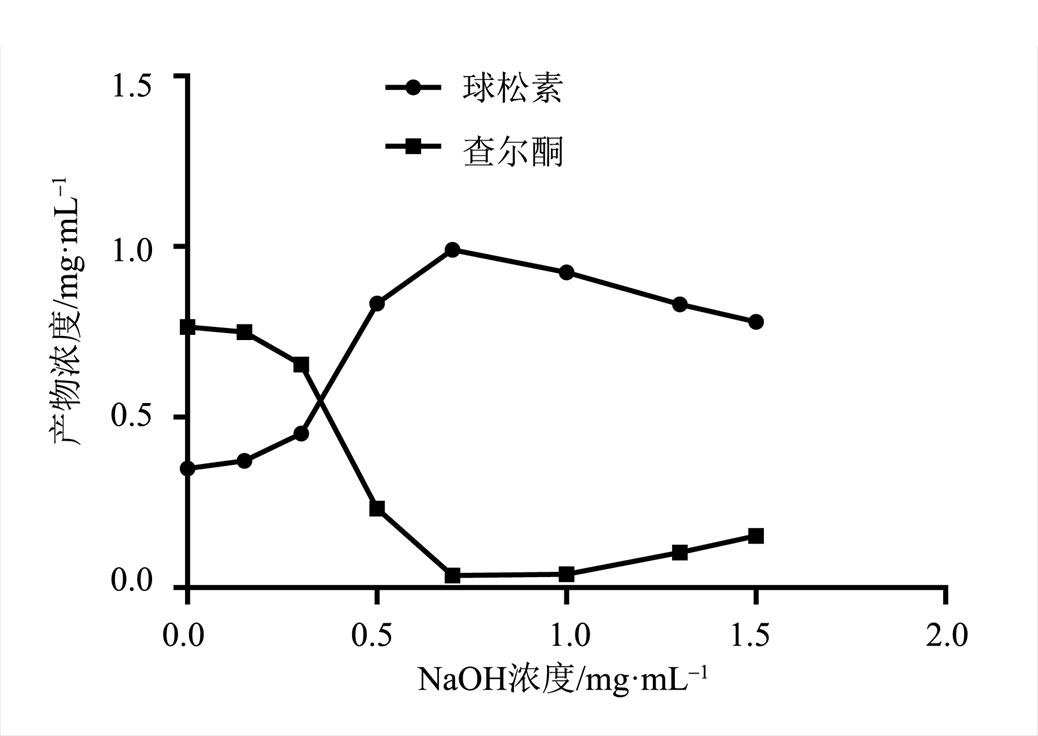
图1 氢氧化钠对样品溶液中球松素浓度的影响
Fig. 1 Effects of the sodium hydroxide on the concentration of pinostrobin in sample solution
朱学鑫1,庞敏霞2,3,黄燕芬2,黄伟鹏2,蒋福升2,金波2,丁志山2*
(1.余姚市中医医院,浙江余姚 315400;2.浙江中医药大学,杭州 310053;3.浙江工业大学,杭州 310014)
摘要:目的优化山核桃叶球松素的制备工艺,为进一步开发利用山核桃叶提供理论依据。方法采用单因素试验,山核桃叶通过乙醇回流提取,氢氧化钠变性,聚酰胺吸附并洗脱,石油醚萃取,乙醇结晶等步骤,以球松素作为检测指标,进行RP-HPLC测定。结果山核桃叶球松素的制备工艺为山核桃叶粉末用10倍量的95%乙醇回流提取2次,每次30 min,以体积比400︰5的比例往提取液中加入1 mol·L-1氢氧化钠溶液,静置过夜取上清,以液质比20︰1的比例与聚酰胺混合并旋蒸至干燥,先用15倍量聚酰胺体积的水洗去杂质,再用15倍量聚酰胺体积的20%乙醇溶液洗去杂质,最后用15倍量聚酰胺体积的60%乙醇溶液解吸附;收集60%乙醇溶液洗脱液,浓缩至干后,获得球松素含量在20%左右的粗产物,以液质比50︰3的比例将此粗产物溶解于甲醇溶液中,加入等体积石油醚,连续萃取10次,收集石油醚产物,再将此产物用乙醇进行结晶,获得纯度>90%的球松素。结论该方法稳定可行,适合工业生产;氢氧化钠变性、聚酰胺纯化及结晶是制备高纯度球松素的关键步骤,为球松素大规模制备奠定了基础,也为山核桃叶的开发利用提供了理论依据。
关键词:山核桃叶;球松素;制备工艺;聚酰胺;氢氧化钠
山核桃叶为胡桃科山核桃属山核桃(Carya cathayensisSarg.)的干燥树叶,是一种民间用药,其性凉,味苦、涩,具有清热解毒、杀虫止痒的功效,广泛分布于浙、皖两省交界的天目山区[1]。山核桃叶含有较多的黄酮类物质,球松素是其主要的黄酮类成分之一[2]。近年来研究发现,球松素具有多种生物学活性,如抗炎、抗溃疡、抑制血管生成和抑制神经毒性等作用[3-7],并且本课题组前期药理学研究证明球松素是山核桃叶抗氧化的主要药效物质,而大规模制备高纯度球松素工艺未有文献报道。因此本实验对山核桃叶中球松素的提取纯化过程进行了研究,确定了最佳工艺,并测定了球松素的纯度,为新药开发中大规模提取分离山核桃叶球松素提供技术支持。
山核桃叶于2014年11月采自浙江杭州淳安县威坪镇汪川村,经浙江中医药大学丁志山教授鉴定为胡桃科山核桃树属山核桃(Carya cathayensisSarg.)的干燥树叶。
甲醇(色谱纯,天津赛孚瑞科技有限公司,批号:20130925002);乙醇(分析纯,无锡市佳妮化工有限公司,批号:20130805);其他试剂为分析纯(天津市永大化学试剂有限公司),水为重蒸水。100~200目聚酰胺(浙江台州市路桥四甲生化塑料厂,批号:20150911),球松素由本实验室制备液相制得,经归一化法测定其纯度为99.2%。
美国戴安公司Ultimate 3000型高效液相色谱仪系统、AcclaimTM120 C18色谱柱(250 mm× 4.6 mm,5 µm);BD 211D电子天平(德国赛多利斯,十万分之一);SZ-93A自动双重纯水蒸馏器(上海亚荣生化仪器厂);SENCOR-R502B旋转蒸发器(上海申顺生物科技有限公司)。
依据实验室前期优化建立的反相HPLC进行球松素含量测定[8],即:采用戴安Ultimate 3000 系统,使用AcclaimTM120 C18色谱柱(250 mm× 4.6 mm,5 µm),以甲醇-0.1%乙酸水溶液(70︰30)为流动相,流速1.0 mL·min-1,柱温为30 ℃,检测器为戴安Ultimate 3000 DAD,以284 nm为检测波长,对样品溶液中球松素进行含量测定。配制系列浓度球松素对照品溶液,按前述反相HPLC测定峰面积,以浓度为纵坐标,峰面积为横坐标进行线性回归。
结果显示,保留时间为23.74 min,回归方程为:Y=0.001 6X-0.054(r=0.999 9,n=6),线性范围为0.012 5~0.250 mg·mL-1。
称取山核桃叶粉末200.0 g,用10倍量95%乙醇回流提取2次,每次30 min,将提取液用滤纸减压过滤,获得滤液,4 ℃保存备用[1]。用移液枪吸取样品溶液4 mL,分别加入1 mol·L-1的氢氧化钠0,15,30,50,70,100,130,150 µL,上下颠倒,充分混合,室温静置30 min,取上清,过0.22 µm滤膜,HPLC检测样品溶液中球松素的含量。
结果显示,随着样品溶液中氢氧化钠含量的增加,样品溶液中球松素浓度呈现先增加后缓慢降低的变化,其中当氢氧化钠浓度为0.7 mg·mL-1时,球松素浓度从0.352 mg·mL-1增加到0.980 mg·mL-1,增加了2.78倍,达到最大,同时球松素查尔酮的浓度降至最低。结果见图1。

图1 氢氧化钠对样品溶液中球松素浓度的影响
Fig. 1 Effects of the sodium hydroxide on the concentration of pinostrobin in sample solution
称取100~200目聚酰胺5.00 g,分别加入经氢氧化钠处理后的样品溶液50,75,100,200,300,400 mL,在500 mL圆底烧瓶中充分混合,经旋转蒸发仪减压浓缩,挥去乙醇,至干燥。将负载样品溶液的聚酰胺放入层析柱(1.8 cm×33.0 cm)中,先用15 BV蒸馏水洗脱(5.00 g聚酰胺的柱体积为22.0 mL),除去未被聚酰胺吸附的物质,再用15 BV 95%乙醇洗脱,收集乙醇洗脱液,并经HPLC检测洗脱液中球松素的浓度。通过回收率来确定样品溶液和聚酰胺之间的最佳固液比。回收率(R)公式如下:R=C2×V2/(Ci×Vi)×100%。
其中Ci和C2分别为样品溶液和乙醇洗脱液中球松素的浓度(mg·mL-1),Vi和V2分别为样品溶液和乙醇洗脱液的体积(mL)。
结果显示,每5 g聚酰胺,当样品溶液体积为75,100 mL时,聚酰胺对球松素具有较高的回收率,分别为89%和85%,两者差异较小,当样品溶液体积超过100 mL时,球松素回收率急剧降低,有大量球松素未被聚酰胺吸附,从节约实验材料和降低实验成本角度出发,笔者最终选择了每100 mL样品溶液与5 g聚酰胺的比例进行混合。结果见图2。
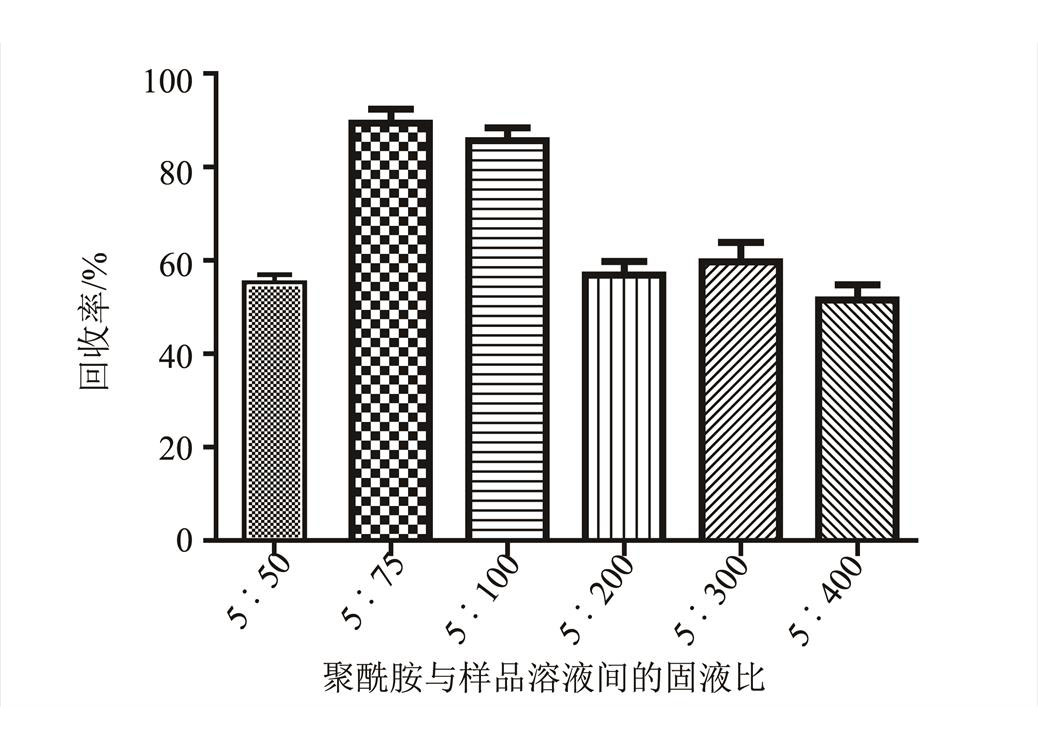
图2 聚酰胺树脂和样品溶液的固液比对聚酰胺树脂回收率的影响
Fig. 2 Effects of the solid-liquid ratio between polyamide resin and sample solution on the recovery of polyamide resin
称取100~200目聚酰胺5.00 g,7份,加入经氢氧化钠处理后的样品溶液100 mL,在500 mL圆底烧瓶中充分混合,经旋转蒸发仪减压浓缩,挥去乙醇,至干燥。将负载样品溶液的聚酰胺放入层析柱(1.8 cm×33.0 cm)中,先用15 BV蒸馏水洗脱,除去未被聚酰胺吸附的物质,再分别用15 BV 20%,30%,40%,50%,60%,70%,80%乙醇溶液洗脱,收集乙醇洗脱液,经旋转蒸发仪减压浓缩,挥去乙醇,至干燥,获得粗产物,HPLC检测粗产物中球松素的含量。
结果显示,与其他洗脱液相比,当洗脱液乙醇浓度为60%时,洗脱物中球松素总量最大,球松素纯度最高,约为22%,因此选择60%乙醇溶液作为后续实验中的洗脱液。结果见表1。
称取100~200目聚酰胺5.00 g,加入经氢氧化钠处理后的样品溶液100 mL,在500 mL圆底烧瓶中充分混合,经旋转蒸发仪减压浓缩,挥去乙醇,至干燥。将负载样品溶液的聚酰胺放入层析柱(1.8 cm×33.0 cm)中,先用15 BV蒸馏水洗脱,除去未被聚酰胺吸附的物质,再用60%乙醇洗脱,收集乙醇洗脱液,每隔5 mL或者10 mL,对洗脱液中球松素浓度进行HPLC检测,从而确定最佳的洗脱体积。
结果显示,15 BV 60%乙醇溶液可几乎将吸附的球松素完全解吸附,因此确定洗脱体积为15 BV,结果见图3。
表1 洗脱液乙醇浓度对球松素解吸附的影响
Tab. 1 Effect of the concentration of eluent liquid (ethanol) on the desorption of pinostrobin

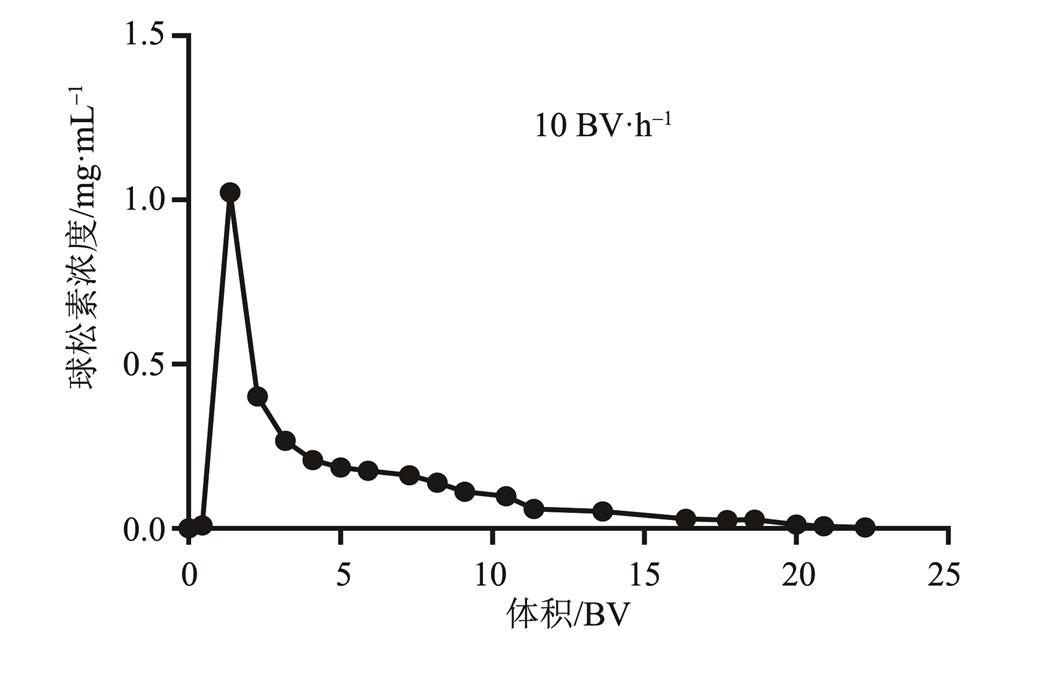
图3 球松素解吸附曲线
Fig. 3 Dynamic desorption curves of Pinostrobin at 10 BV·h-1
称取400.0 g山核桃叶粉末,用10倍量95%乙醇回流提取2次,每次30 min,将提取液用滤纸减压过滤,获得滤液6 000 mL,加入氢氧化钠4.50 g,混合均匀,静置过夜,再次过滤取滤液。往上清液中加入100~200目聚酰胺300 g,经旋转蒸发仪减压浓缩,挥去乙醇,至干燥。将负载样品溶液的聚酰胺放入层析柱(7.5 cm×90.0 cm)中,先用15 BV蒸馏水洗脱,接着用15 BV 20%乙醇洗脱,最后用15 BV 60%乙醇洗脱,收集60%乙醇洗脱液,减压旋蒸至干燥,获得粗产物15.45 g(图4A),HPLC检测粗产物中球松素的纯度为21.20%。
称取上述粗产物33.50 g,超声溶解于500 mL甲醇溶液中,3 000 r·min-1的转速离心15 min,取上清。往上清液中加入石油醚,每次500 mL,连续萃取10次,收集石油醚层,减压旋蒸至干燥,获得深黄色粗产物(图4B)18.72 g,并将此产物在90 ℃水浴中溶解于70.0 mL 95%乙醇中,再缓慢加入15.0 mL蒸馏水,降低球松素在乙醇溶液中的溶解度。在90 ℃水浴中静置15 min,取上清,迅速放于4 ℃冰箱中,静置12 h。静置结束后,有大量晶体产生,经布氏漏斗抽滤,烘干,获得浅黄色产物(图4C)2.11 g,经HPLC检测球松素的纯度为92.30%。

图4 样品示意图
A-放大试验后产物;B-石油醚萃取后产物;C-结晶后产物。
Fig. 4 Sample diagram
A-crude product from laboratory preparative-scale test; B-thick yellow crude product from petroleum ether extraction; C-pinostrobin crystals.
准确称取最后获得的产品,并用无水乙醇配成1.0 mg·mL-1,过0.22 µm滤膜,备用。原样品溶液和氢氧化钠处理后的样品溶液,分别过0.22 µm滤膜,备用。将上述3种溶液,按“2.1”项下HPLC条件进行检测。
样品溶液经过氢氧化钠处理后,球松素查尔酮绝大部分转变成球松素,并经后续最佳条件下处理后,大部分杂质被除去或保留在聚酰胺柱上,最后获得的产品球松素纯度>90%。结果见图5。
聚酰胺树脂是一类由酰胺聚合而成的高分子物质,主要通过氢键和范德华力进行吸附,对黄酮类化合物有较强的选择吸附特性,并且是可逆的,其分离效果好,可分离极性相近的类似物;其柱层析的样品容量大,适用于制备分离[9-10]。本课题组前期考察了5种不同目数的聚酰胺(14~30,30~60,60~100,80~120,100~200目)对球松素回收率的影响,结果发现随着聚酰胺目数的增加,聚酰胺粒径的减小,球松素的回收率逐渐增加,其中80~120目和100~200目聚酰胺具有较高的回收率,两者之间无显著性差异,但是100~200目聚酰胺略高于80~120目聚酰胺,因此在本实验中,选用100~200目聚酰胺纯化山核桃叶中的球松素。
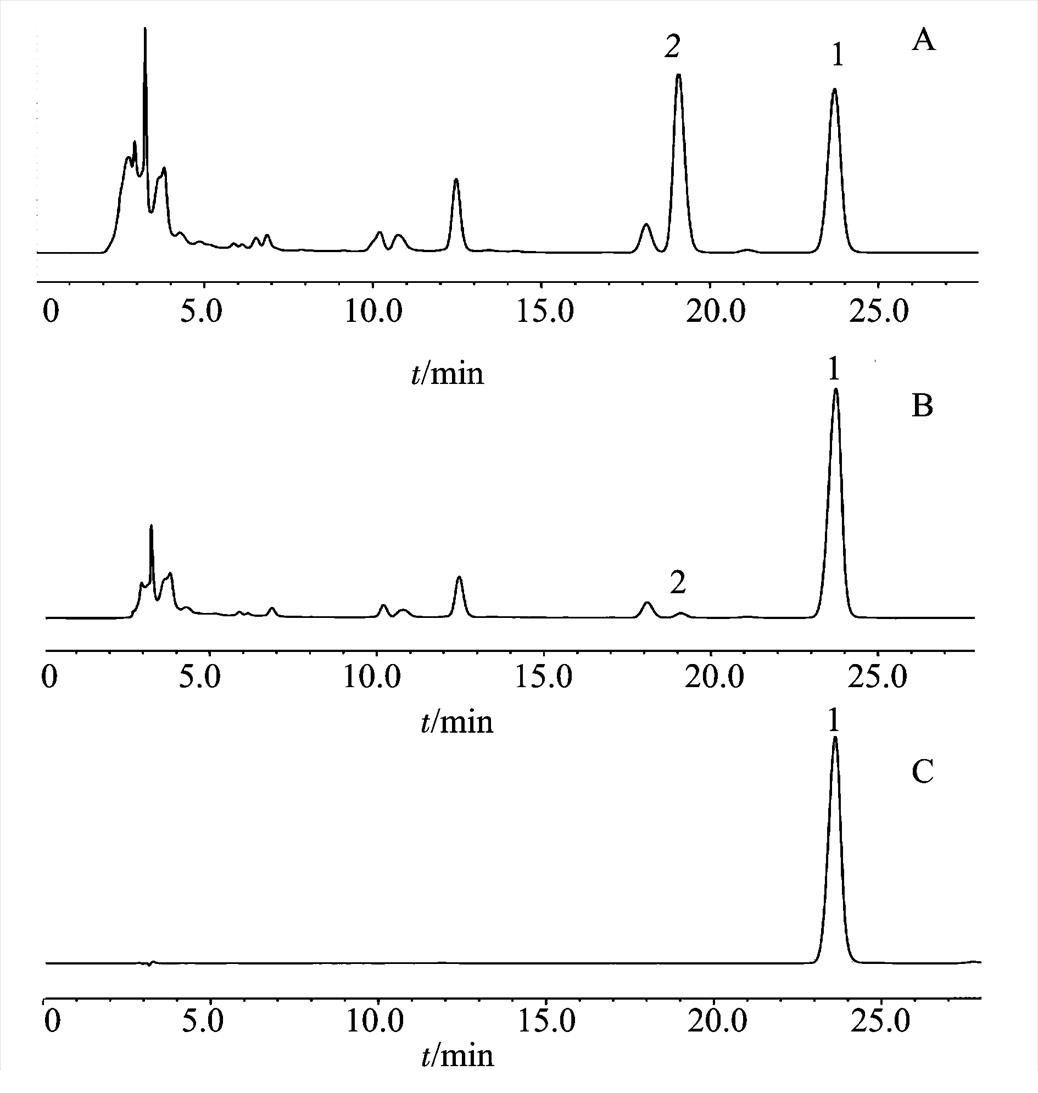
图5 高效液相色谱图
A-样品溶液;B-氢氧化钠处理后样品溶液;C-最佳工艺条件下的最终产品。1-球松素;2-球松素查尔酮。
Fig. 5 HPLC chromatograms
A-sample solution; B-sample solution after treatment with sodium hydroxide; C-final product under optimum technical condition (crystallization); 1-pinostrobin; 2-pinostrobin chalcone.
球松素和球松素查尔酮互为同分异构体,在一定的条件下,可以相互转变[11]。本课题组前期在一次偶然的实验中,发现球松素查尔酮在碱性条件下能大量转变成球松素,因此进行了深入研究,结果发现样品溶液中,随着氢氧化钠含量的增加,球松素浓度急剧增加,但当氢氧化钠含量为0.7 mg·mL-1时,球松素浓度达到最大,此后随着氢氧化钠含量的增加,溶液中球松素浓度略微下降;另一方面,随着氢氧化钠含量的增加,球松素浓度急剧增加时,球松素查尔酮急剧下降,当氢氧化钠含量为0.7 mg·mL-1时,球松素查尔酮浓度下降到最低,由此笔者推测,溶液中增加的球松素来自球松素查尔酮的转变。而当氢氧化钠含量从0增加到0.7 mg·mL-1时,溶液中球松素的浓度从0.352 mg·mL-1增加到0.980 mg·mL-1,增加了约2.78倍。因此在后续的实验中,本课题组选择氢氧化钠含量为0.7 mg·mL-1,使球松素查尔酮最大程度上转变成球松素。
本实验首次使用氢氧化钠将山核桃叶提取液中的球松素查尔酮转变成球松素,从而使样品溶液中球松素的浓度大大提高,降低高纯度球松素制备的难度,并对此步骤进行多次考察,确定氢氧化钠能使提取液中球松素查尔酮转变成球松素,具有较好的重复性。并且对聚酰胺的用量比,洗脱液乙醇浓度及用量进行了详细的考察,并进行了放大实验,石油醚萃取,乙醇结晶等步骤,使该工艺简单易行,具有较好的可行性。在后续球松素制备过程中,均采用最佳工艺,获得的产品中球松素纯度均>90%,说明此工艺稳定可行,具有较好的重复性。本实验为新药开发中大规模提取分离山核桃叶球松素提供了技术支持,也为进一步开发利用山核桃叶提供了理论依据。
REFERENCES
[1] ZHU X X, LI W P, YU Y, et al. Total flavonoids of theCarya cathayensisSarg leaves [J]. Chin Arch Tradit Chin Med(中华中医药学刊), 2013, 31(1): 73-75.
[2] ZHU X X, JIANG R B, HUANG J J, et al. Comparative study of primary flavonoid aglycones content in levels ofCarya cathayensisSarg. from different areas in Zhejiang province [J]. Chin Arch Tradit Chin Med(中华中医药学刊), 2015, 33(10): 2351-2353.
[3] PATEL, N K, BHUTANI K K. Pinostrobin and Cajanus lactone isolated fromCajan cajan(L.) leaves inhibits TNF-aand IL-1bproduction:in vitroandin vivoexperimentation [J]. Phytomidicine, 2014, 21(7): 946-953.
[4] ABDELWAHAB S I, MOHAN S, ABDULLA M A, et al. The methanolic extract ofBoesenbergia rotunda(L.) Mansf. and its major compound pinostrobin induces anti-ulcerogenic propertyin vivo: possible involvement of indirect antioxidant action [J]. J Ethnopharmacol, 2011, 137(2): 963-970.
[5] SIEKMANN T R, BURGAZLI K M, BOBRICH M A, et al. The antiproliferative effect of pinostrobin on human umbilical vein endothelial cells(HUVEC) [J]. Eur Rev Med Pharmacol Sci, 2013, 17(5): 668-672.
[6] TIAN S S, JIANG F S, ZHANG K, et al. Flavonoids from the leaves ofCarya cathayensisSarg. inhibit vascular endothelial growth factor-induced angiogenesis [J]. Fitoterapia, 2014(92): 34-40.
[7] XIAN Y F, IP S P, LIN Z X, et al. Protective effects of pinostrobin on β–amyloid-induced neurotoxicity in PC12 cells [J]. Cell Mol Neurobiol, 2012, 32(8): 1223-1230.
[8] SHEN Y, LIU N N, XU M, et al. HPLC determination of the content of the five flavonoid aglycones from the leaves ofCarya cathayensisSarg. [J]. Chin J Pharm Anal (药物分析杂志), 2013, 33(5): 804-807.
[9] ZHOU XI, XU C H, SHEN J J, et al. Determination of Desloratadine Citrate Disodium in Rat and Pharmacokinetic Study by L-MS/MS [J]. Chin J New Drugs Clin Rem(中国新药与临床杂志), 2015, 34(11):. 874-879.
[10] HUANG H B, LIU H C, JIN Z M, et al. Proanthocyanidins fromGinkgo bilobaL. and their anti-oxidant activities [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(6): 686-690.
[11] ZHAO H J, REN Q X, FAN Y H, et al. Preparation of isoliquiritin using the quality of reciprocal transformation of flavanones and chalcones [J]. Food Sci Technol(食品科技), 2011, 36(10): 210-213.
(本文责编:李艳芳)
Study on Preparation Process of Pinostrobin from the Leaves ofCarya CathayensisSarg.
ZHU Xuexin1, PANG Minxia2,3, HUANG Yanfen2, HUANG Weipeng2, JIANG Fusheng2, JIN Bo2, DING Zhishan2*
(1.Yuyao Hospital of T.C.M, Yuyao 315400, China;2.Zhejiang Chinese Medical University, Hangzhou 310053, China; 3.Zhejiang University of Technology, Hangzhou 310014, China)
ABSTRACT:OBJECTIVETo optimize the preparation process of pinostrobin from the leaves ofCarya cathayensisSarg. and to provide theoretical basis for further development and utilization of the leaves.METHODSSignal factor test was investigated to optimize the manufacturing process of pinostrobin. Pinostrobin was obtained by alcohol-backflow extracting, sodium hydroxide degeneration, adsorption and desorption of polyamide resins, extract of petroleum ether, alcohol crystallization and determined by RP-HPLC.RESULTSThe best preparation process of pinostrobin was as follows: the powdered leaves were extracted twice with 95% ethanol by reflux for 30 min at 100 ℃. Add 1 mol·L-1sodium hydroxide solution to the extraction solution with a volume ratio of 400︰5, then let it rest the night and take the supernatant mixed with polyamide and rotate to dry with liquid ratio 20︰1. The sample-laden polyamide resins were added to a glass column and first washed with 15 BV deionized water, second with 15 BV 20% ethanol-water solution and last with 15 BV 60% ethanol-water solution which was concentrated and dried. Crude from 60% ethanol-water solution was dissolved in methanol and extracted 10 times continuously with petroleum ether. The product from petroleum ether was dissolved and crystallized in ethanol-water solution and the pinostrobin with high purity (> 90%) was obtained.CONCLUSIONThe method is stable and feasible, and is suitable for industrial production. Sodium hydroxide degeneration, adsorption and desorption of polyamide resins and alcohol crystallization are the key steps to obtain high purity pinostrobin which can lay the foundation for pinostrobin preparation at large scale, also provides theoretical basis for the development and utilization of the leaves.
KEY WORDS:Carya cathayensisSarg.; pinostrobin; preparation process; polyamide resin; sodium hydroxide
中图分类号:R284.2
文献标志码:B
文章编号:1007-7693(2017)11-1512-05
DOI:10.13748/j.cnki.issn1007-7693.2017.11.002
引用本文:朱学鑫, 庞敏霞, 黄燕芬, 等. 山核桃叶球松素制备工艺研究[J]. 中国现代应用药学, 2017, 34(11): 1512-1516.
基金项目:国家自然科学基金(81303258)
作者简介:朱学鑫,男,博士 Tel: 13666600557 E-mail: 13666600557@163.com
*通信作者:丁志山,男,博士,教授 Tel: 15658857028 E-mail: dzszjtcm@163.com
收稿日期:2017-04-30