图1 空白辅料色谱图
Fig. 1 HPLC chromatogram of blank excipients solution
马莉,刘兆迅,王文笙,陶元景*
(山东达因海洋生物制药股份有限公司,山东荣成 264300)
摘要:目的探索不同制备工艺对格列美脲片溶出行为的影响。方法以溶出度及在pH(7.20±0.05)缓冲液中溶出曲线为检测指标,并结合流动性和可压性,考察粉末直接压片、干法制粒压片、湿法制粒压片对格列美脲片溶出行为的影响。结果采用粉末直接压片、干法制粒压片、湿法制粒压片工艺制备的格列美脲片溶出行为存在一定差异。结论采用空白辅料湿法制粒,外加原料药混合压片制得格列美脲片与参比制剂溶出行为一致,且产品质量稳定,为格列美脲片一致性评价工作奠定了基础。
关键词:格列美脲片;制备工艺;溶出度
格列美脲,用于治疗采取节食和运动而未能控制的Ⅱ型糖尿病[1],因其降糖作用平稳有效,且不良反应少,临床应用日益广泛。但是,格列美脲片由于药物的溶解度较小,进而导致给药后血药浓度偏低,生物利用度不高[2]。目前,国家食品药品监督管理总局要求对格列美脲片以原研药为参比制剂,体外溶出曲线为核心考察指标[3],与参比制剂进行全面的质量研究对比。本研究考察了不同制备工艺对格列美脲片溶出行为的影响,筛选出适合现有处方的最佳制备工艺,提高了产品的溶出速率,确保了产品质量,达到了与参比制剂质量和疗效一致的水平。
1260高效液相色谱仪,包括四元泵、DAD检测器、标准自动进样器等(美国Agilent);XP-205型微量分析天平(瑞士梅特勒公司);FADT-1202RC自动溶出仪(上海富科斯);ZS-2E型振实仪(天大天发);PTG-S4粉末流动性测试仪(Pharma-test);G10实验型多功能湿法制粒机(深圳市信宜特科技);HD15多项运动混合机(上海天祥健台制药机械有限公司);ZP10A旋转压片机(国药龙立)等。
格列美脲(山东达因制药,批号:151091-1,含量:99.2%);乳糖(Meggle,Flowlac 100,批号:L1345);微晶纤维素(FMC,Avicel PH112,批号:91531C);预胶化淀粉(卡乐康,Starch 1500,批号:IN527691);羧甲淀粉钠(DFE,Primojel,批号:100GBG5);硬脂酸镁(山东聊城阿华制药,批号:20141219);滑石粉(广西龙胜华美,批号:1407129)。
格列美脲对照品(批号:100674-201503,含量:99.6%)、格列美脲杂质Ⅲ对照品(批号:100675-201402,含量97.8%)购自中国药品生物制品检定研究院;亚莫利®(sanofi-aventis U.S.LLC,批号:4T003)等。
格列美脲20 g、乳糖400 g、微晶纤维素300 g、预胶化淀粉200 g、羧甲淀粉钠50 g、滑石粉20 g、硬脂酸镁10 g,制得10 000片。
分别按照处方量称取主药和各种辅料,通过等量递增法混合均匀压片,作为样品A。
分别按照处方量称取主药和各种辅料,通过等量递增法将除滑石粉和硬脂酸镁外原辅料混合均匀。辊压、粉碎,24目筛整粒。整粒后加入助流剂滑石粉和润滑剂硬脂酸镁,混合均匀,压片,作为样品B。
2.4.1 主药内加 分别按照处方量称取主药和各种辅料,通过等量递增法将除滑石粉和硬脂酸镁外原辅料混合均匀。加入10%~20%纯化水制备软材,24目筛制粒,颗粒于烘箱(60 ℃)烘干,24目筛整粒。整粒后加入润滑剂硬脂酸镁和助流剂滑石粉,混合均匀,压片,作为样品C。
2.4.2 主药外加 分别按照处方量称取主药和各种辅料,将除格列美脲、滑石粉和硬脂酸镁外辅料混合均匀,加入10%~20%纯化水制备软材,24目筛制粒,颗粒于烘箱(60 ℃)烘干,24目筛整粒。整粒后,通过等量递增法将格列美脲与干颗粒混合均匀,再加入润滑剂硬脂酸镁和助流剂,混合均匀,压片,作为样品D。
用ZS-2E型振实仪测定不同工艺制得颗粒的振实密度,以卡尔指数[8](%)表示:卡尔指数<20%表示粉体可压性好;21%<卡尔指数<25%,表示粉体可压性一般;卡尔指数>26%,表示粉体可压性差。用PTG-S4粉末流动性测试仪测定不同工艺制得颗粒的流动性,以休止角(°)表示:休止角<31°,表示粉体的流动性好;31°<休止角<36°,表示粉体流动性一般;休止角>36°,表示粉体流动性差。
测定不同工艺制得样品的溶出度。溶出度依照中国药典[10]2015年版第二部“格列美脲片”质量标准修订方法进行测定。
2.7.1 格列美脲对照品储备液配制 格列美脲对照品约10 mg,精密称定,置100 mL量瓶中,加乙腈适量使溶解并稀释至刻度,摇匀,作为对照品储备液。
2.7.2 色谱条件 色谱柱:YMC-Pack ODS-AM (4.6 mm×150 mm,S-5 μm);流动相:乙腈-0.1%磷酸二氢钠溶液(用磷酸调pH值至3.0±0.5)(50︰50);流速:1.0 mL· min-1;检测波长:228 nm;柱温:30 ℃;进样量:50 μL。在此色谱条件下,格列美脲的保留时间为7.4 min。所用空白辅料不干扰测定。结果见图1~2。

图1 空白辅料色谱图
Fig. 1 HPLC chromatogram of blank excipients solution
图2 格列美脲对照品色谱图
Fig. 2 HPLC chromatogram of glimepiride control solution
2.7.3 溶出曲线方法学验证 参考日本医院药剂师委员会制定的关于格列美脲片IF(interview form)文件及长期探索结果表明,格列美脲片在pH (7.20±0.05)磷酸缓冲液中溶出曲线具有区分力[12]。因此,对格列美脲片在pH(7.20±0.05)磷酸缓冲液中溶出曲线测定方法进行验证。验证结果:空白辅料对测定无干扰,格列美脲浓度在0.41~ 2.49 μg·mL-1内线性良好(r≥0.999);高、中、低3个浓度平均回收率为96.6%~102.2%(n=9),RSD均≤2.30%;精密度RSD均≤7.02%(n=12);48 h内溶液稳定(RSD均≤0.7%,n=7);通过改变液相条件(流速、温度和流动相比例)考察得系统耐受性良好,以上结果均符合定量分析要求。
2.7.4 溶出曲线方法 测定不同工艺制得样品与参比制剂的溶出曲线。各样品随机取12片,以pH(7.20±0.05)磷酸盐缓冲液900 mL为溶出介质,转速为50 r·min-1,依法操作,分别在5,15,30,45,60 min取溶液5 mL(并及时在操作容器中补充溶出介质5 mL),滤过,取续滤液作为供试品溶液;精密量取对照品储备液1 mL,置50 mL量瓶中,用溶出介质稀释至刻度,摇匀,作为对照品溶液。按照“2.7.2”项下的色谱条件进行测定。
按照“2.4.2”项下工艺连续制备3批样品,并进行铝塑包装,置温度(40±2)℃、相对湿度(75±5)%的条件下放置6个月后,测定其有关物质、溶出度。
不同工艺制得颗粒的密度和休止角见表1,由结果可知,采用粉末直接压片工艺比干法制粒压片工艺、湿法制粒工艺制备的粉体流动性和可压性差,该工艺可能导致片剂重量差异、脆碎度不符合规定,放大生产会有一定风险。
表1 不同样品密度和休止角
Tab. 1 Density and repose angle of particles from different sample

不同工艺制得格列美脲片溶出度大小顺序为D>A>B>C,结果见表2。采用4种工艺制得格列美脲片溶出度均符合规定,而空白辅料湿法制粒外加主药压片工艺制得格列美脲片溶出度最高。
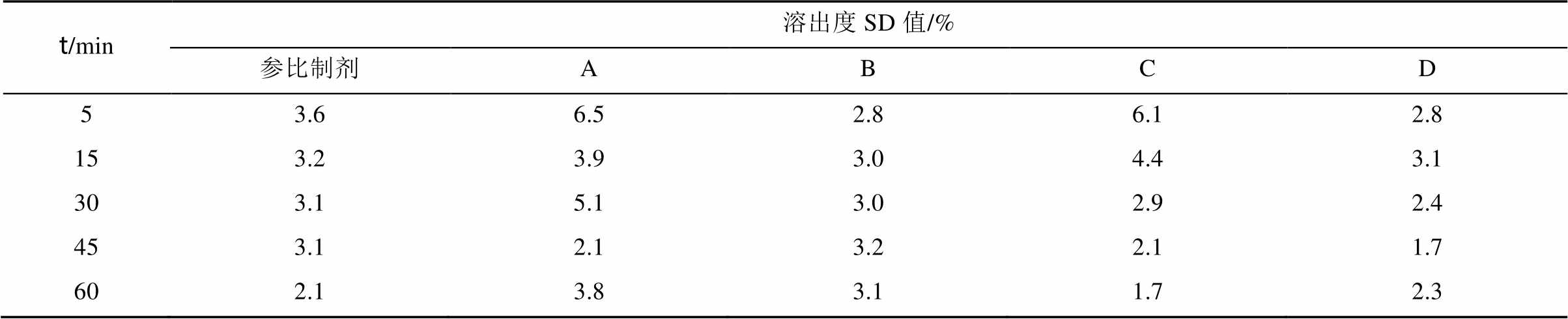
粉末直接压片、干法制粒压片、湿法制粒压片-主药内加、湿法制粒压片-主药外加工艺制得格列美脲片与参比制剂在pH(7.20±0.05)磷酸盐缓冲液中溶出曲线相似因子分别为42,51,44,70,见图3,测定结果偏差范围见表3。采用粉末直接压片、内加主药湿法制粒压片工艺制得样品与参比制剂的溶出行为不相似;干法制粒压片工艺制得样品与参比制剂的溶出行为相似,但相似因子为51,可能增加BE试验不成功的风险;空白辅料湿法制粒外加主药压片制备样品与参比制剂溶出曲线相似因子可达70。
表2 不同样品溶出度测定结果(n=6)
Tab. 2 Dissolution test results of different samples(n=6) %

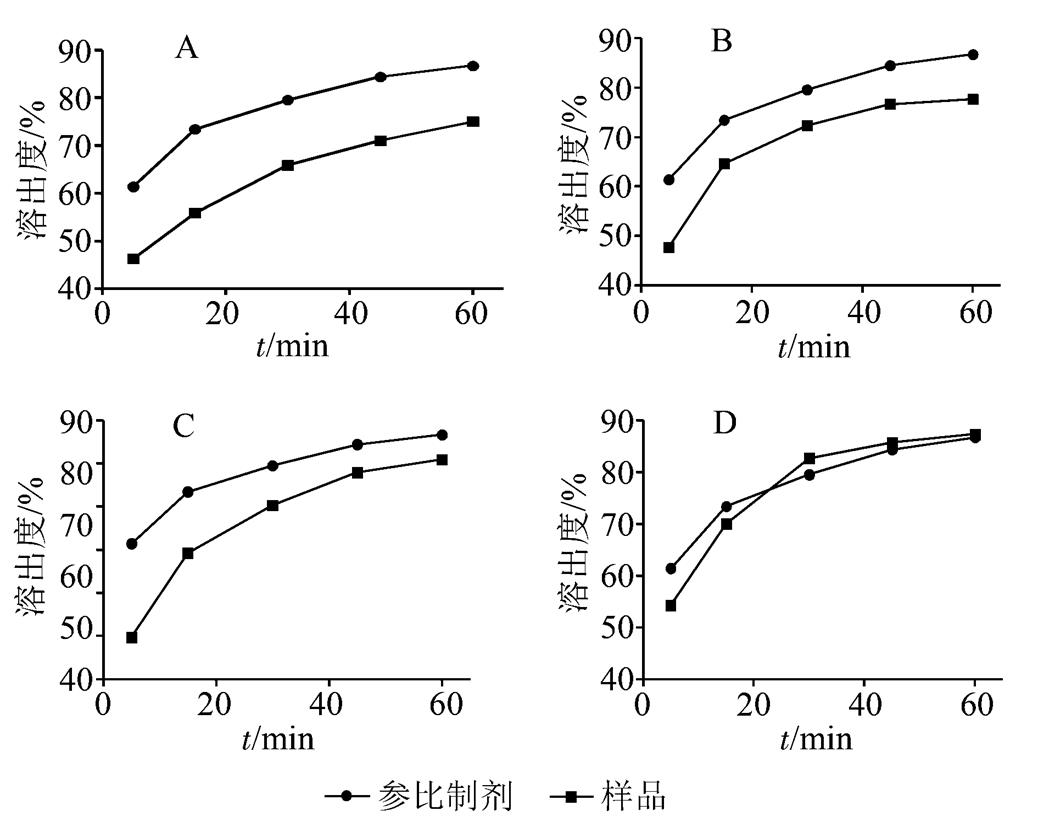
图3 不同样品与参比制剂在pH(7.20±0.05)磷酸盐缓冲液中溶出曲线比较(n=12)
Fig. 3 The compare results of dissolution profiles in pH (7.20±0.05) phosphate buffer solution between different samples and reference preparation(n=12)
表3 参比制剂与不同样品溶出度SD值
Tab. 3 The dissolution SD value of reference preparation and different samples
采用空白辅料湿法制粒外加主药混合压片工艺制备样品,在加速条件下放置6个月后,有关物质及溶出度符合规定,样品稳定性较好。溶出度测定结果见表4。杂质Ⅲ测定结果见表5。
表4 稳定性加速试验溶出度测定结果(n=6)
Tab. 4 Stability acceleration dissolution test results(n=6) %
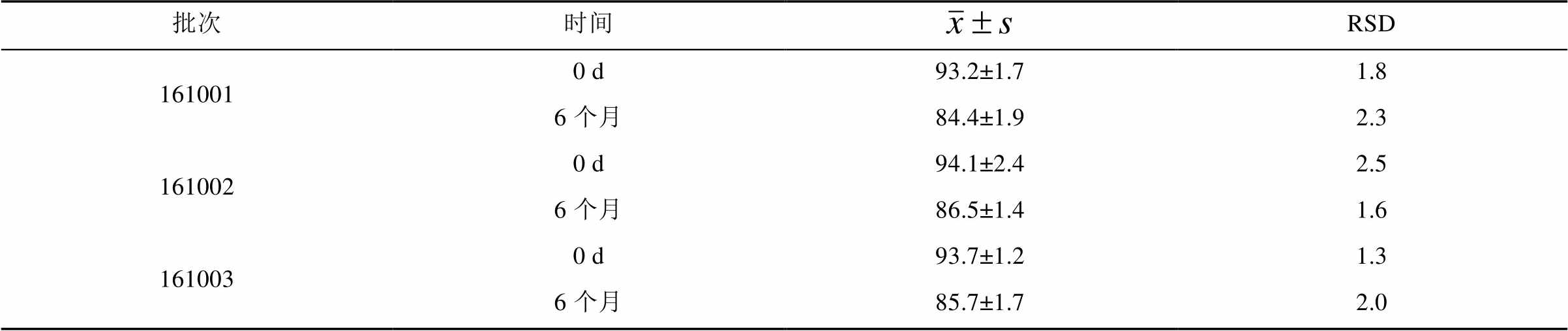
表5 稳定性加速试验杂质Ⅲ测定结果
Tab. 5 Stability acceleration impurity Ⅲ test results

注:杂质Ⅲ是格列美脲片剂中主要降解杂质,其受高温氧化条件影响较大,因此作为格列美脲片有关物质中关键考察项目。
Note: Impurity Ⅲ is the main impurity in the degradation of glimepiride tablets by high temperature oxidation conditions, a greater impact, so as a key investigation project related substances in Glimepiride Tablets.
通过对上述结果分析,不同制备工艺对产品粉体状态及溶出行为有较大的影响。按传统的湿法制粒压片工艺制备的格列美脲片,由于格列美脲被包裹在颗粒中不易崩解释放,从而导致溶出度低,影响生物利用度;按照粉末混合直接压片、干法制粒压片工艺制备的格列美脲片虽然溶出度较高,但与参比制剂溶出行为不一致,且粉末直接压片工艺对辅料及要设备性能要求比较高,否则影响格列美脲片的产品质量。
目前,国内外未报道采用空白辅料湿法制粒外加主药工艺制备格列美脲片,该制备工艺可提高药物的溶出速率,且格列美脲片剂与参比制剂溶出行为相似,提高了药物生物利用度,为格列美脲片质量和疗效一致性评价工作奠定了基础。
REFERENCES
[1] LI H Y, YANG W Z, MA L L, et al. Preparation and dissolution rate evaluation of glimepiride tablets [J]. J Hebei Univ(Nat Sci Edit)(河北大学学报), 2014, 34(5): 491-496.
[2] 朱影影, 金齐武, 王成永. 格列美脲片的工艺改进[J]. 淮南职业技术学院学报, 2012, 14(2): 91-93.
[3] 刘源, 任静, 赖可, 等. 格列美脲片处方工艺筛选及溶出度评价[J]. 医药导报, 2015, 34(3): 399-403.
[4] WENG D M, YANG S S. Preparation of glimepiride tablets by direct powder compression [J]. China Med Pharm(中国医药科学), 2013, 3(22): 46-48.
[5] 李红成. 干法制粒技术在药物研究中的应用进展[J]. 中国药业, 2013, 22(6): 127-128.
[6] 冯莎等. 干法制粒在降糖颗粒制备中的应用[J]. 中国现代药物应用, 2013, 7(1): 120-121.
[7] WANG R Y, LIU Y, TOM D. Comparison of binder in roller compaction [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(12): 1543-1547.
[8] Abdulraheman Z S, Patel M R, Patel K R. Formulation and in-vitro evaluation of atomoxetine HCl immediate release tablet [J]. Int J Univ Pharmacy Bio Sci(国际制药和生物科学杂志), 2014, 3(3): 217.
[9] 高立军, 王维贤. 格列美脲片溶出度方法研究[J]. 药物分析杂志, 2002, 2(6): 486-487.
[10] 中国药典. 二部[S]. 2015: 1124-1125.
[11] XIE M F. Evaluation methods of comparability of dissolution curve [J]. Chin J Pharm(中国医药工业杂志), 2009, 40(4): 308-310.
[12] XIE M F. The dissolution curve with distinguishing ability [J]. Chin J Pharm(中国医药工业杂志), 2014, 45(7): 687-689.
(本文责编:李艳芳)
Effects of Different Preparation Process on the Dissolution Behavior of Glimepiride Tablets
MA Li, LIU Zhaoxun, WANG Wensheng, TAO Yuanjing*
(Shandong Dyne Marine Biopharmaceutical Co., Ltd., Rongcheng 264300, China)
ABSTRACT:OBJECTIVETo explore the effects of different preparation process on the dissolution behavior of Glimepiride tablets.METHODSUsing the dissolution and dissolution curve in pH(7.20±0.05) buffer as index, based on fluidity and compressibility to investigate the effects of power tabletting, dry granulation tabletting and wet granulation tabletting methods on the dissolution behavior of Glimepiride tablets.RESULTSIt had different effects on the dissolution of Glimepiride tablets by power tabletting, dry granulation tabletting and wet granulation tabletting.CONCLUSIONThe Glimepiride tablets, which are made by mixing blank materials wet granulation with raw materials tabletting, has the same dissolution behavior with the reference preparation. And the production quality is stability, which is helpful for the consistency evaluation of Glimepiride tablets.
KEY WORDS:Glimepiride tablets; preparation process; dissolution
中图分类号:R944.4
文献标志码:B
文章编号:1007-7693(2017)11-1572-04
DOI:10.13748/j.cnki.issn1007-7693.2017.11.016
引用本文:马莉, 刘兆迅, 王文笙, 等. 制备工艺对格列美脲片溶出行为的影响[J]. 中国现代应用药学, 2017, 34(11): 1572-1575.
作者简介:马莉,女,硕士,工程师 Tel: (0631)7606291 E-mail: 286231792@qq.com
*通信作者:陶元景,男,硕士,工程师 Tel: (0631)7606207 E-mail: taoyuanjing@dynemed.com
收稿日期:2017-04-25