表1 硝苯地平原料药与不同辅料混合情况
Tab. 1 Tablets of nifedipine with different excipients

谢升谷1,张丽娟2,陈悦1,洪利娅1*
(1.浙江省食品药品检验研究院,杭州 310052;2.嘉兴市食品药品检验检测院,浙江嘉兴 314001)
摘要:目的考察硝苯地平缓释片中原料药与辅料的相容性,为更好地设计处方,控制和提高质量提供依据和信息。方法采用中国药典2015年版二部硝苯地平原料药项下有关物质检查方法,考察有关物质变化,作为不同辅料对硝苯地平缓释片光稳定性的影响指标。结果在光照条件下,硝苯地平易产生光降解杂质2,且微晶纤维素和硬脂酸镁会加速杂质2的产生。结论在满足相关制剂要求的条件下,建议尽量少加或不加微晶纤维素和硬脂酸镁。
关键词:硝苯地平缓释片;杂质;辅料;微晶纤维素;硬脂酸镁
硝苯地平为一类二氢吡啶类的钙拮抗剂,属于短效制剂,临床上主要用于高血压、心绞痛及其他心血管疾病的治疗,其化学名称为2,6-二甲基-4-(2-硝基苯基)-1,4-二氢-3,5-吡啶-1-甲酸二甲酷[1-4]。其市场上制剂主要有片剂(包括普通片剂和缓释片剂)、胶囊剂(包括硬胶囊、软胶囊、缓释胶囊等)。各国药典,包括中国药典2015版、USP40和EP9.0项下收载质量标准均需避光操作,其光降解杂质分别为杂质1和杂质2[5-7]。硝苯地平遇光极不稳定,分子内部易发生光化学歧化作用,降解为硝苯吡啶衍生物(杂质1)及亚硝苯吡啶衍生物(杂质2)。本研究主要对硝苯地平缓释片进行辅料与原料药相容性进行试验,发现不同的辅料对其光降解杂质产生具有不同的作用。
Agilent 1260高效液相色谱仪(美国Agilent公司);AE-163电子天平(瑞士梅特勒公司)。
硝苯地平缓释片(批号:20160605)、原料药(批号:A160202)、硬脂酸镁、微晶纤维素等辅料均由浙江昂利康制药股份有限公司提供。硝苯地平对照品(批号:100338-201404,纯度:99.9%)、杂质1对照品(批号100339-201103,纯度:99.3%)、杂质2对照品(批号:100340-201103,纯度:99.7%)均由中国食品药品检定研究院提供。甲醇为色谱纯,实验用水为超纯水。
参照中国药典2015年版二部硝苯地平原料药项下有关物质的检查方法[5],色谱柱为Agilent XDB-C18(4.6 mm×150 mm,5 μm),以甲醇-水(60︰40)为流动相进行洗脱,流速为1.0 mL·min-1,柱温为30 ℃,检测波长为235 nm,进样量为20 μL,进样盘避光处理。
取硝苯地平杂质1对照品、杂质2对照品和硝苯地平对照品适量,精密称定,加甲醇溶解并用流动相定量稀释制成每1 mL中各约含1 μg的混合溶液,作为对照品溶液。
取硝苯地平原料药,按表1中硝苯地平原料药与辅料比例混合,在光照(4 500±500)Lx下分别放置0,5,10 d后,再进行供试品溶液制备。避光操作,取上述细粉适量,约相当于硝苯地平50 mg,精密称定,置50 mL量瓶中,加甲醇适量,超声使硝苯地平溶解,放冷,用甲醇定容。取溶液适量,离心,取上清液作为供试品溶液。
表1 硝苯地平原料药与不同辅料混合情况
Tab. 1 Tablets of nifedipine with different excipients

注:混合辅料为微晶纤维素、乳糖、淀粉、吐温-80、硬脂酸镁按处方量混合。
Note: The excipients were microcrystalline cellulose, lactose, starch, Twain-80, magnesium stearate mixed by prescription.
取上述各个编号制备得到的供试液,分别精密量取20 μL注入液相色谱仪,记录色谱图。结果见图1。
取上述编号1~9号供试品溶液,分别测定光照条件下0,5,10 d的结果。见表2~3。
结果显示未经光照的硝苯地平原料药中检测到的杂质含量<0.1%,经5,10 d光照后的杂质总量分别为7.1%,18.1%,说明硝苯地平原料药在光照条件下不稳定,易产生杂质。硝苯地平原料药与微晶纤维素混合的样品在5 d和10 d分别检测到的杂志总量为14.9%和32.6%,与硝苯地平原料药中杂质总量相比,原料药与微晶纤维素混合样品中检测到的杂质总量在5 d和10 d分别高出7.8%和14.5%。硝苯地平原料药与硬脂酸镁混合的样品在5 d和10 d分别检测到的杂质总量为15.4%和31.8%,与硝苯地平原料药中杂质总量相比,原料药与硬脂酸镁混合样品中检测到的杂质总量在5 d和10 d分别高出8.3%和13.7%。
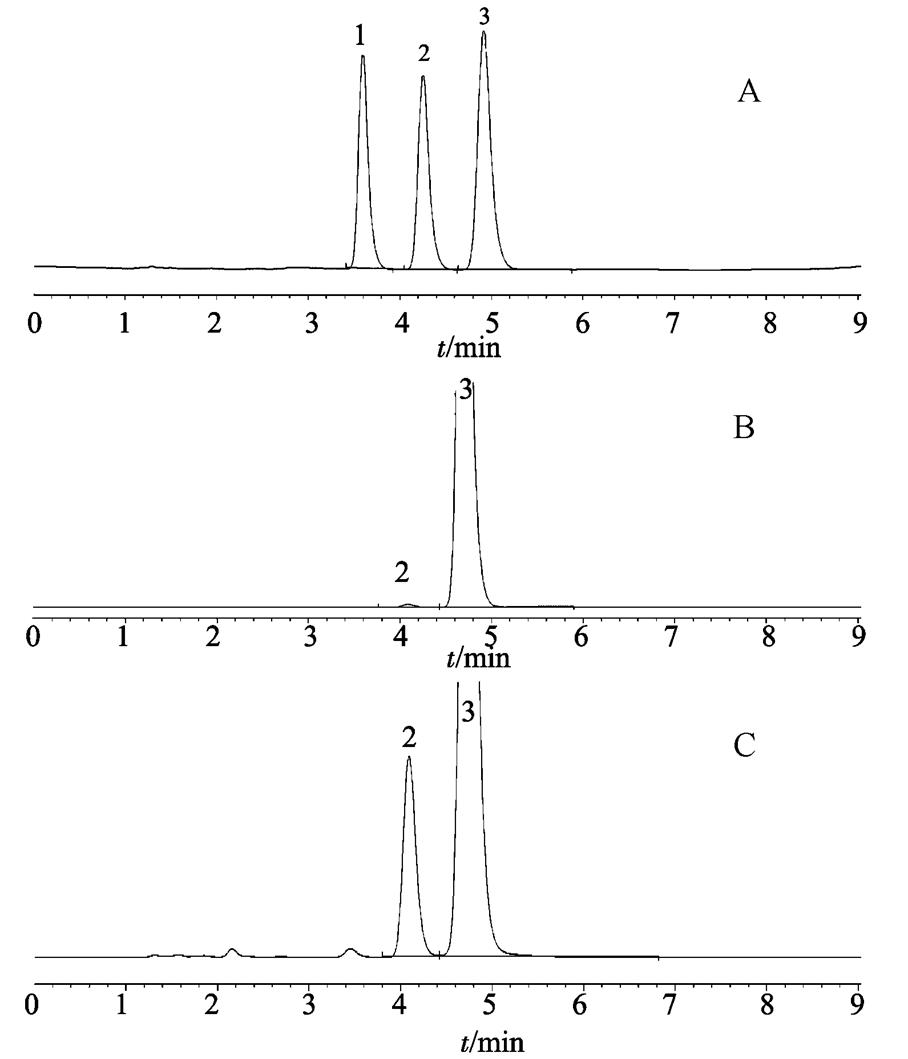
图1 HPLC图
A-对照品溶液;B-3号供试液光照0 d;C-3号供试液光照10 d;1-杂质1;2-杂质2;3-硝苯地平。
Fig. 1 HPLC chromatograms
A-reference substance solution; B-No.3 sample solution light for 0 d; C-No.3 sample solution light for 10 d; 1-impurities 1; 2-impurities 2; 3-nifedipine.
比较表2和表3的降解杂质产生的数据可知,降解杂质的产生主要由杂质2组成,杂质2占杂质总量90%以上。实验表明辅料微晶纤维素和硬脂酸镁会明显地加速硝苯地平产生光降解杂质。而其他辅料,如吐温80、淀粉、乳糖等,均与单个原料药产生的降解杂质含量一致,无加速降解杂质产生的现象。同时编号9为硝苯地平缓释片成品制剂研成粉末后进行测定,其结果与原料药加辅料混合后进行测定基本一致。
表2 辅料相容性杂质总量测定结果
Tab. 2 The determination results of amount of impurities about material compatibility %

注:-表示未检出。
Note:-indication not detected.
表3 辅料相容性杂质2测定结果
Tab. 3 The determination results of impurity 2 about material compatibility %
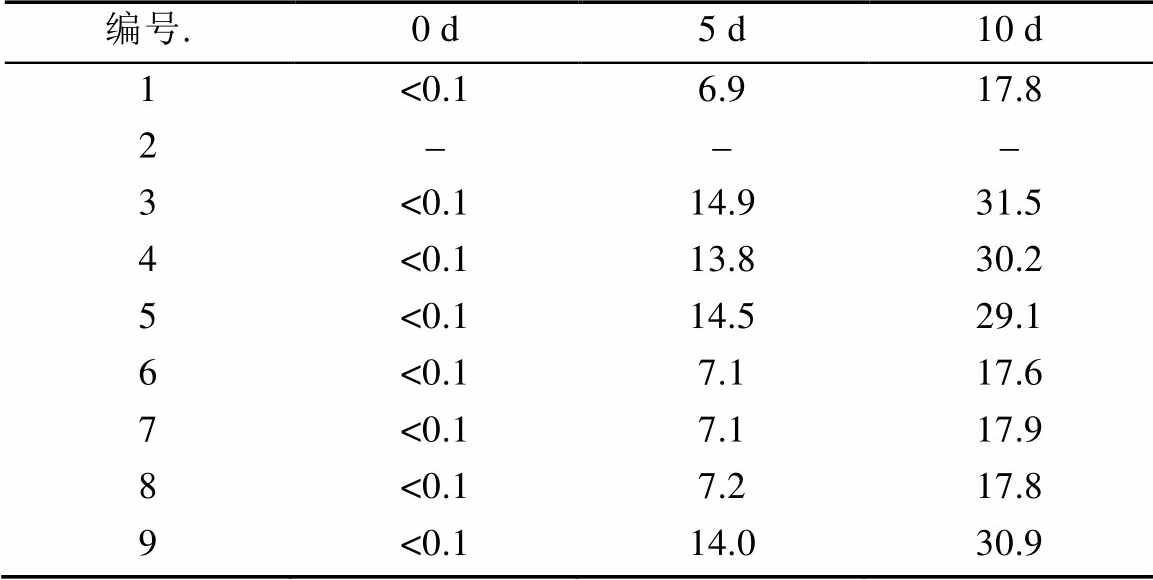
注:-表示未检出。
Note:-indication not detected.
对硝苯地平原料药和硝苯地平缓释片进行酸、碱、氧化、光照和热破坏,发现其最不稳定的条件为光照,而在其他条件下相对较为稳定。同时包括USP36、EP8.0和中国药典2015年版等药典项下该品种项下均要求避光操作,且其最主要的杂质均为光降解杂质,故最后选择光照作为原辅料相容性的加速条件。硝苯地平遇光极不稳定,分子内部易发生光化学歧化作用,降解为亚硝苯吡啶衍生物,即杂质2。沙振方等[8]采用HPLC对硝苯地平的杂质进行分析,朱培曦等[9]采用HPLC-MS对硝苯地平的杂质进行分析,其主要的杂质均为已知杂质。同时采用中国药典2015年版测定方法,故未用HPLC-MS对样品中的杂质峰进行质谱确认。
随着对辅料与原料相互作用的研究深入,曹筱琛等[10]对药物与辅料相容性研究进展作了相关的阐述,表明药物与辅料的相互作用可改变药物活性分子的理化性质,影响药物的稳定性和有效性。李军等[11]对阿替洛尔片原料与辅料相容性问题进行探讨,发现原料与相关辅料相互作用,导致杂质发生了变化。蒋林波[12]对以乳糖为辅料的苯磺酸氨氯地平片工艺进行优化,提示不同的处方工艺对药物的杂质有影响。微晶纤维素和硬脂酸镁广泛应用于药物制剂辅料,前者主要是在口服固体制剂中作为黏合剂或稀释剂,不仅可用于湿法制粒而且可用于直接压片;后者主要用于口服固体制剂中的润滑剂、助流剂。通过硝苯地平缓释片中的各个处方辅料进行相容性研究,发现硬脂酸镁和微晶纤维素与硝苯地平都会加速光歧化反应,加速杂质2的产生。本研究对象为硝苯地平缓释片,但微晶纤维素和硬脂酸镁2个辅料也广泛应用于其他类型的固体制剂中,如片剂、颗粒剂、胶囊剂等,该研究结果也可为硝苯地平其他固体制剂处方筛选时提供参考。药品临床使用的安全性与药品中的杂质密切相关,在满足制剂处方要求的情况下,建议尽量选用相关替代品或减少微晶纤维素和硬脂酸镁的用量。
REFERENCES
[1] BROGDEN R N, MCTAVISH D. Nifedipine gastrointestinal therapeutic system (GITS): a review of its pharmaconamic and pharmacokinetic properties and therapeutic efficacy in hypertension and angina pectoris [J]. Drugs, 1995, 50(3): 495-512.
[2] SORKIN E M, CLISSOLD S P, BROGDEN R N. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic efficacy, in ischaemin heart disease, hypertension and related cardiovascular disorders [J]. Drug Eval, 1985(30): 182-274
[3] DI F C, LAMPA E, FORGIONE A. et al. Effects of nifedipine controlled release on blood pressure and heart rate of spontaneously hypertensive rats, Comparison with nifedipine standard and with amlodipine [J]. Ital Heart J Suppl, 2005, 6(5): 285-290.
[4] HE S Z, LIN Y, LIANG Z J. Case analysis of rifampicin reducing antihypertensive effects of nifedipine [J]. Pharmacy Today(今日药学), 2015, 25(10): 733-735.
[5] 中国药典. 二部[S]. 2015: 1286-1287.
[6] USP 40 [S]. 2017: 5351-5352.
[7] EP 9.0 [S]. 2016: 3151-3152.
[8] SHA Z F, GAO H, SUN W J, et al. Determination of nifedipine and related impurities by HPLC methods [J]. Chin JPharm(中国医药工业杂志), 1993, 24(4): 176-179.
[9] ZHU P X, DING L X, HE J J, et al. Rapid characterization of impurities in the bulk drug of nifedipine by high performance liquid chromatography-quadrupole time of fight mass spectrometry [J]. Chin J Chrom(色谱), 2012, 30(10): 1026-1030.
[10] CAO X C, JIA F, TAO Q F. Progress in the study of drug-excipient compatibility in dosage forms [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2013, 30(2): 223-228.
[11] LI J, WEN P, GAO Y L, et al. Discussion on compatibility between atenolol and different excipients [J]. China Pharm(中国药师), 2014, 17(8): 1428-1429.
[12] JIANG L B. Technology optimization of amlodipine besylate tablets using lactose as excipient [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(1): 68-71.
(本文责编:李艳芳)
Effects of Different Excipients on the Photostability of Nifedipine Sustained-Release Tablets
XIE Shenggu1, ZHANG Lijuan2, CHEN Yue1, HONG Liya1*
(1.Zhejiang Institute for Food and Drug Control, Hangzhou 310052, China; 2.Jiaxing Institute for Food and Drug Inspection and Testing, Jiaxing 314001, China)
ABSTRACT:OBJECTIVETo investigate the compatibility of APIs with nifedipine sustained release tablets and to provide basis and information for better prescription design, control and quality improvement.METHODSAccording to the determination methods for the relative substances innifedipine in ChP2015, to examine the changes of relative substances, as effects of different excipients on the photostability of nifedipine sustained-release tablets.RESULTSIn the light conditions, nifedipine could produce photodegradation impurities 2, and microcrystalline cellulose and magnesium stearate will accelerate the production of impurities 2.CONCLUSIONUnder the conditions required to meet the requirements of the relevant preparation, it is recommended to use as little or no microcrystalline cellulose andmagnesium stearate.
KEY WORDS:nifedipine sustained-release tablets; impurity; excipients; microcrystalline cellulose; magnesium stearate
中图分类号:R917
文献标志码:B
文章编号:1007-7693(2017)11-1557-03
DOI:10.13748/j.cnki.issn1007-7693.2017.11.012
引用本文:谢升谷, 张丽娟, 陈悦, 等. 不同辅料对硝苯地平缓释片光稳定性影响研究[J]. 中国现代应用药学, 2017, 34(11): 1557-1559.
基金项目:绿色制药协同创新课题;药品医疗器械审评审批制度改革专项课题(ZG2016-4-06)
作者简介:谢升谷,男,硕士,副主任药师 Tel: (0571)86459422 E-mail: xiesgu@163.com
*通信作者:洪利娅,女,硕士,主任药师 Tel: (0571)86454617 E-mail: hongliya@zjyj.org.cn
收稿日期:2017-04-10