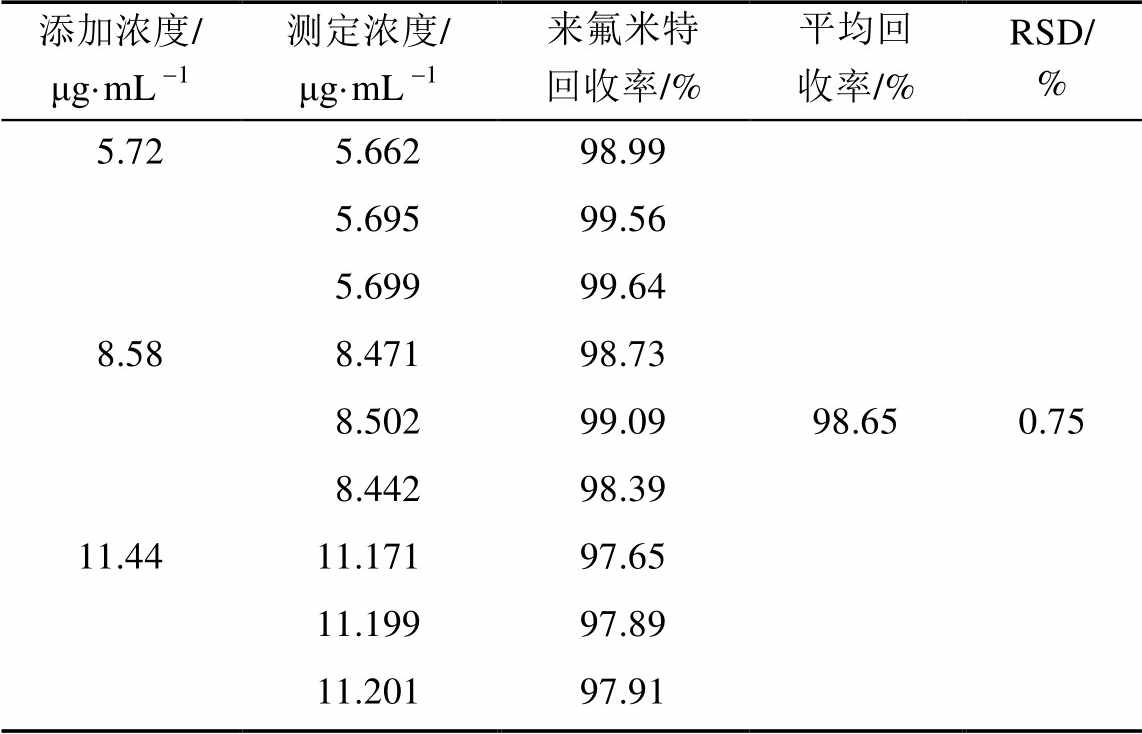
表1 回收率试验结果
Tab. 1 Results of recovery tests
赵海云,王松,张冬梅,李玉杰,杨娜,凌霄*
(山东省食品药品检验研究院,济南 250101)
摘要:目的改进现行来氟米特片溶出度测定方法。方法通过对溶出介质、转速、取样时间的一系列考察,最终确定采用桨法,以0.5%十二烷基硫酸钠为溶出介质,转速为75 r·min-1,经45 min取样,采用高效液相色谱法,在210 nm波长下按外标法以峰面积计算溶出度,并对建立的方法进行了方法学验证。结果来氟米特浓度在0.6~14.3 μg·mL-1内线性关系良好,Y=72.157X+2.748 6,R2=1,平均回收率为98.7%;采用建立方法测试,同一企业产品溶出度均一性良好,对不同企业产品具有良好的区分力。结论建立方法革除了药典方法中采用的有机溶剂,方便有效,区分力强,可作为来氟米特片质量控制方法。
关键词:来氟米特片;溶出度;高效液相色谱法
来氟米特是一个具有抗增殖活性的异唑类免疫调节剂[1],最初是由德国Hoechest Marion Roussel公司开发研制的一种新型免疫调节剂,是一种新型抗类风湿性关节炎药,第一个被批准用于该适应证的口服药物。来氟米特属低溶解性、高渗透性药物,生物药剂学分类属BCS二类[2];来氟米特片现收载于中国药典2015年版二部[3]与USP39[4],比较中国药典与USP39溶出度测定方法,两者差异较大,USP39所用溶出介质为水,转速为100 r·min-1,经30 min取样,限度为不得低于标示量的80%;而中国药典所用溶出介质为30%乙醇溶液制成的含0.5%十二烷基硫酸钠溶液,转速为100 r·min-1,经45 min取样,限度为不得低于标示量的75%。中国药典采用加表面活性剂的有机溶液,与体内吸收条件差异较大,且方法缺乏区分力。为更好地控制和评价各厂家产品质量,本实验对来氟米特片的溶出度测定方法进行了研究,制定出一个比较科学、合理、有区分力的溶出度测定方法。
Agilent 1200高效液相色谱仪(美国Agilent公司),色谱柱为Kromasil C18键合硅胶柱(150 mm×4.6 mm,5 µm),VarianVK7025-VK8000自动溶出度仪(美国Agilent公司)。
供试品来源:各企业产品均来自2016年国家药品计划抽验;原研产品来自Sanofi-Aventis进口片剂(批号:5H03A,规格:10 mg);来氟米特对照品(中国食品药品检定研究院,批号:100571- 200601,纯度:99.7%);乙腈(Merck试剂有限公司,色谱纯);磷酸二氢钾、十二烷基硫酸钠(SDS) (国药集团有限公司,分析纯);超纯水。
2.1.1 对照品溶液 精密称取来氟米特对照品适量,加溶出介质溶解并稀释制成每1 mL中约含11 μg来氟米特的溶液,摇匀,作为对照品溶液。
2.1.2 供试品溶液 取供试品,按溶出度测定法,以0.5% SDS溶液900 mL为溶出介质,转速为75 r·min-1,在各选定时间点取溶液10 mL滤过,取续滤液作为供试品溶液。
Agilent 1200高效液相色谱仪,色谱柱:Kromasil C18(4.6 mm×150 mm,5 μm),柱温:35 ℃;流动相:0.025 mol·L-1磷酸二氢钾-乙腈(60∶40);流速:1.0 mL·min-1,检测波长:210 nm;进样量:20 μL。
2.2.1 线性关系考察 精密称取来氟米特对照品11.47 mg,置100 mL量瓶中,加溶出介质溶解并稀释至刻度,摇匀,作为对照品储备溶液;分别精密量取储备液适量,加溶出度介质稀释制成约为0.57,1.14,2.86,5.71,8.58,11.44,14.29 μg·mL-1的系列溶液,精密量取20 μL注入液相色谱仪测定。以浓度(X)和相应的色谱峰峰面积(Y)作线性回归方程,所得的线性方程为Y=72.157X+2.748 6,R²=1;结果表明,在0.57~14.29 μg·mL-1内线性关系良好。
2.2.2 加样回收率试验 取空白辅料适量,加溶出介质溶解配制成空白辅料溶液,再加入对照品溶液(约11 μg·mL-1)适量,制成含50%,75%,100%对照品各3份的回收率试验溶液,按“2.2”项下色谱条件分别取上述溶液20 μL,注入液相色谱仪测定。计算9份溶液的回收率,结果见表1。回收率试验结果表明,方法的准确度良好。
2.2.3 稳定性试验 取对照品溶液,按“2.2”项下色谱条件,分别于0,2,4,6,8,12 h注入液相色谱仪测定,来氟米特峰面积的RSD为0.1%。结果表明来氟米特在12 h内稳定。
表1 回收率试验结果
Tab. 1 Results of recovery tests

2.3.1 来氟米特BCS分类 采用Gastrol plus 8.0软件对原料的平衡溶解度与油水分配系数进行模拟,结果见图1~2。结果表明来氟米特为非pH值依赖、低溶解性、高渗透性药物,属于BCSⅡ类。
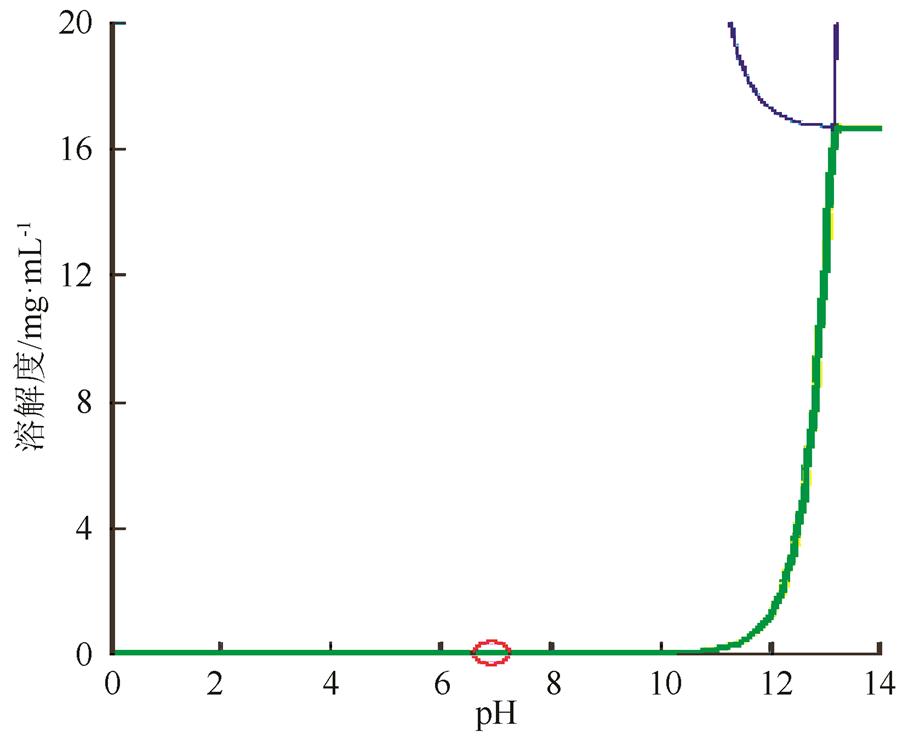
图1 平衡溶解度曲线
Fig. 1 The equilibrium solubility curve
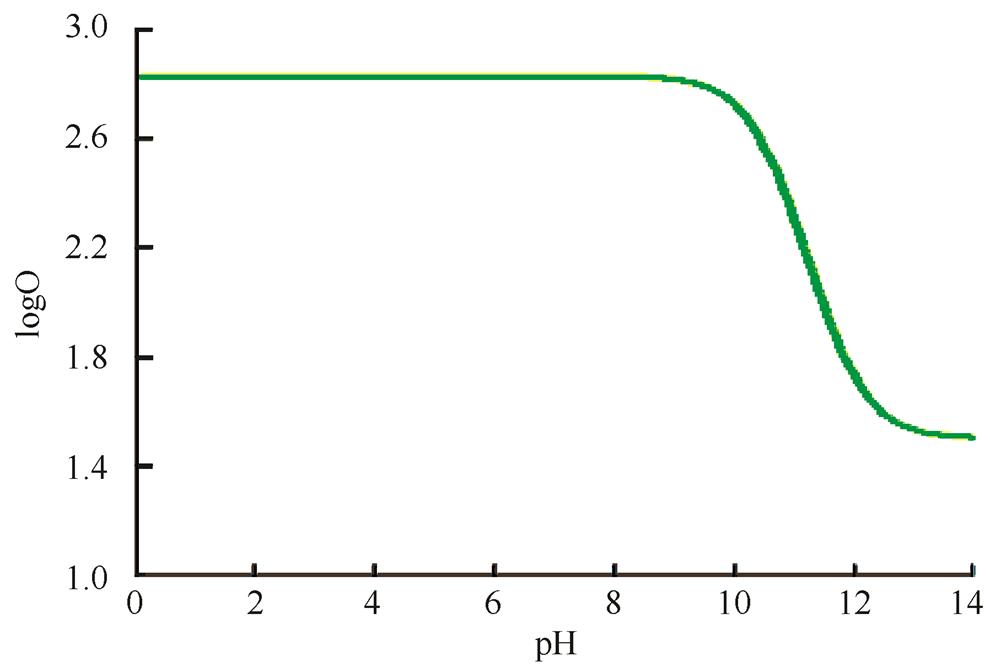
图2 油水分配系数曲线
Fig. 2 Oil-water partition coefficient curve
2.3.2 溶出介质的选择
2.3.2.1 溶出曲线的考察 先选用pH 1.0盐酸溶液、pH 4.5醋酸盐缓冲液、pH 6.8磷酸盐缓冲液、水、模拟人工胃液与模拟人工肠液为溶出介质,转速为100 r·min-1,考察原研制剂Sanofi产品与国内产品的溶出曲线。国内产品与原研产品溶出存在显著差异,在模拟人工胃、肠液中,差异亦未消除,结果见图3。采用USP方法,以水为溶出介质,国内产品不能达到限度要求,故建立一个针对国内产品的溶出度测定方法是本次研究的重点。
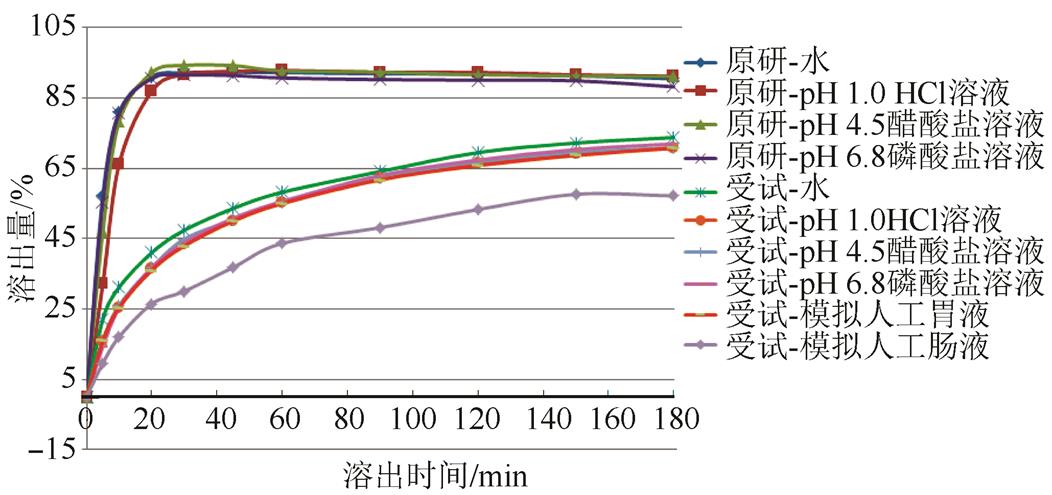
图3 不同溶出介质中溶出曲线的比较
Fig. 3 Comparisons of dissolution curve in different dissolution medium
2.3.2.2 溶出基质的选择 由图3可知,产品在4种溶出介质(水、pH 1.0、pH 4.5、pH 6.8)中,经180 min溶出量仅达70%,均不能完全溶出,在4种溶出基质中分别添加0.5% SDS后,溶出度均得到显著提高,经60 min,溶出量约达到80%,结果见图4。考虑溶出介质的方便实用,最终采用水为溶出基质作进一步的考察。
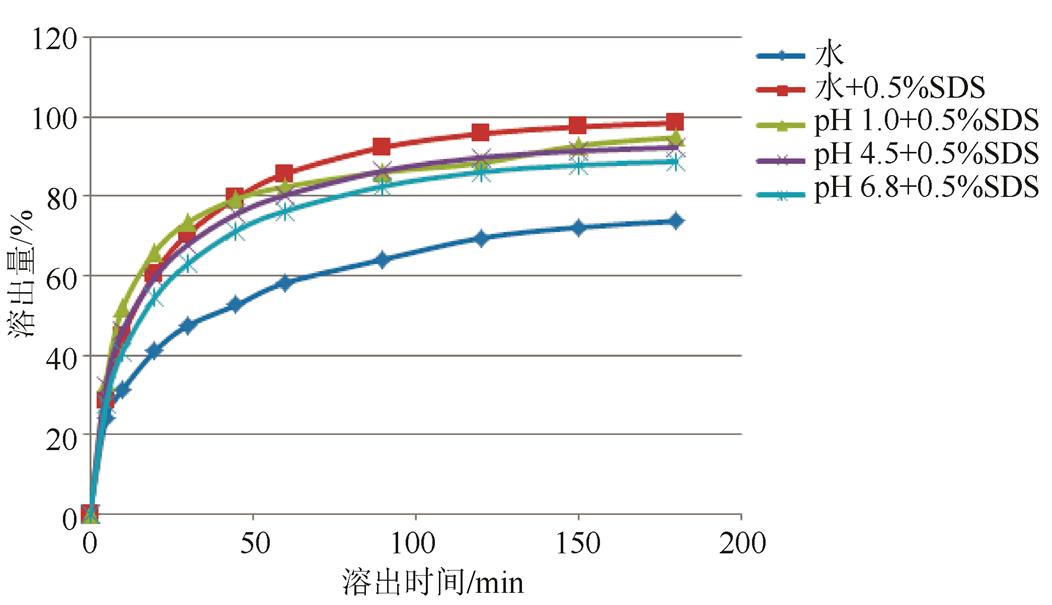
图4 不同pH值缓冲溶液+0.5%SDS作为溶出介质溶出曲线的考察
Fig. 4 The dissolution curve of different pH buffer solution + 0.5% SDS as dissolution medium
2.3.2.3 表面活性剂的选择 以水为溶出基质,分别加入相同浓度(0.5%)的SDS和吐温80,比较2种表面活性剂的增溶效果,发现SDS的增溶效果优于吐温80,故选用SDS作为表面活性剂进一步考察。
2.3.2.4 表面活性剂添加浓度的选择 以水为溶出基质,分别加入0.02%,0.05%,0.1%,0.25%,0.5%,1.0% SDS,转速为75 r·min-1,比较各条件下来氟米特的溶出曲线,结果见图5。来氟米特的溶出量随SDS浓度的增加而增加,综合考虑方法的溶出速率与区分力,选用0.5% SDS为溶出介质。
2.3.3 转速的选择 以含0.5% SDS的水为溶出介质,考察50,75,100 r·min-1条件下的溶出曲线,结果表明溶出速率受转速影响较小,最终选择转速为75 r·min-1。
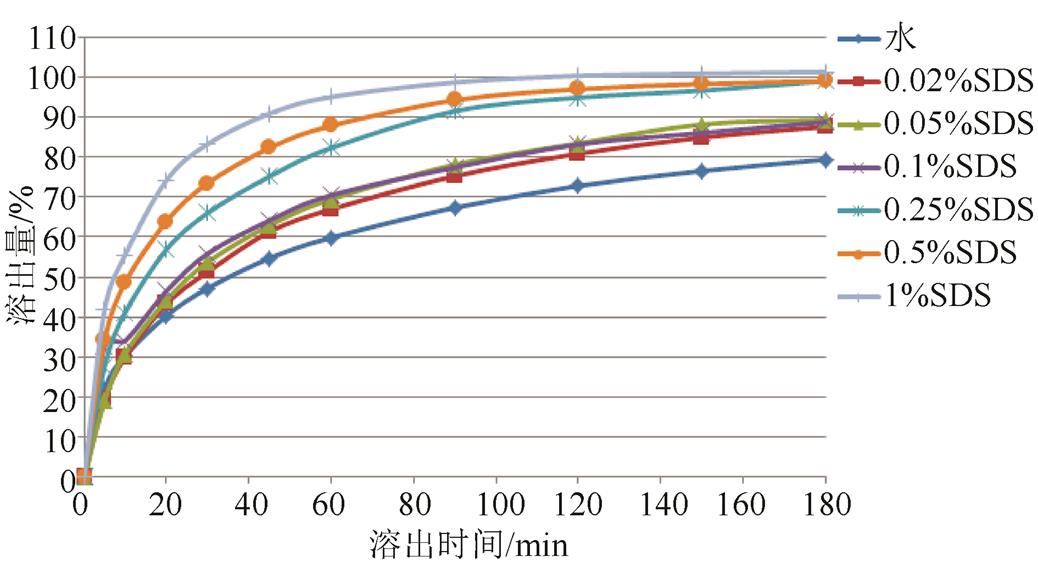
图5 不同浓度SDS溶出曲线比较
Fig. 5 The comparison of dissolution curve with different concentrations of SDS
2.3.4 取样时间点的确立 以0.5% SDS为溶出介质,转速为75 r·min-1,考察各企业产品溶出曲线,结果显示各企业产品可以得到良好的区分,结果见图6。最终确定取样时间为45 min,限度为标示量的75%。
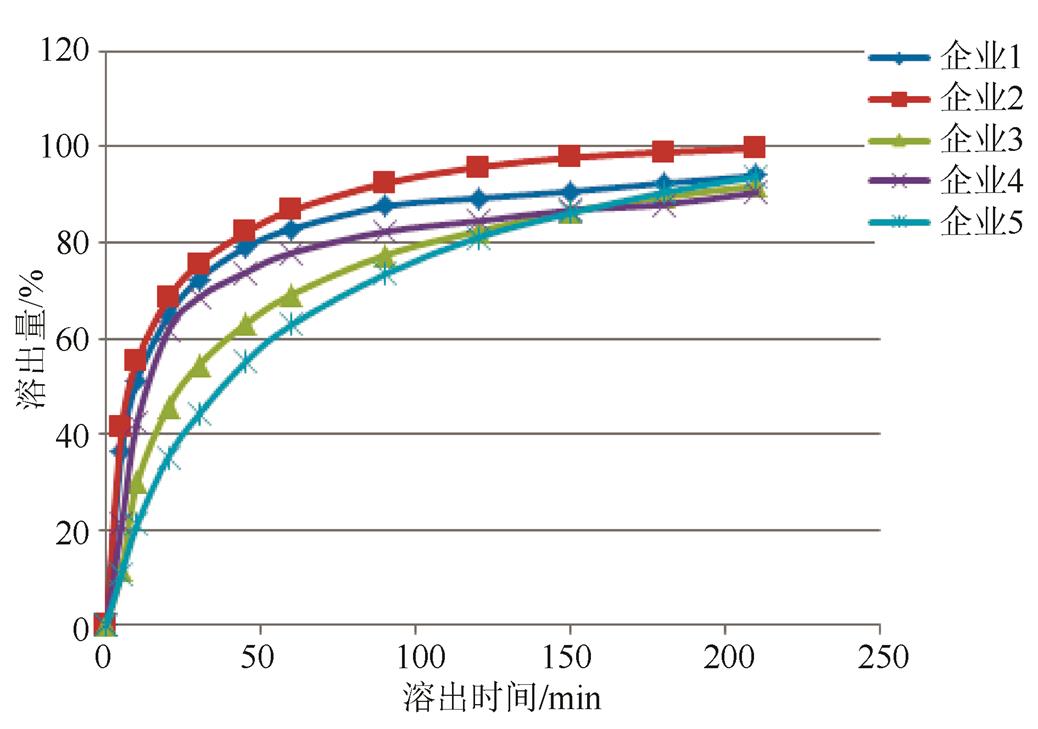
图6 各企业溶出曲线比较
Fig. 6 The comparison of dissolution curve from different enterprise
取本品,照溶出度与释放度测定法(中国药典2015年版通则0931第二法),以0.5%十二烷基硫酸钠溶液900 mL为溶出介质;转速为75 r·min-1,依法操作。经45 min时,取溶液适量,滤过,作为供试品溶液;另取来氟米特对照品,精密称定,加溶出介质溶解并定量稀释制成每l mL中约含11 μg的溶液,作为对照品溶液。照含量测定项下的方法测定,精密量取供试品溶液与对照品溶液各20 μL,分别注入液相色谱仪,记录色谱图,按外标法以峰面积计算每片的溶出量。限度为标示量的75%,应符合规定。
按确定的溶出度方法,选取3家企业的3批次样品分别测定3次,平均溶出量为81%,86%,70%,RSD分别为1.1%,0.8%,0.7%,相同条件下,原研制剂的溶出量为99%,表明国产制剂质量与原研制剂仍有一定差距。
取来氟米特对照品溶液(11 μg·mL-1)用孔径为0.45 μm的有机滤膜过滤,弃去初滤液2 mL后进样,考察过滤前后主峰峰面积,结果表明滤膜对来氟米特无吸附。
分别取各企业处方所用辅料进样,结果表明,辅料对测试结果无影响。
通过对溶出介质的考察,确定采用0.5% SDS为溶出介质,相应的方法学验证均符合要求。本研究除了中国药典2015版二部方法中采用的有机溶剂,溶出条件更温和,溶出方法更合理、有效。
采用建立的溶出度方法,对不同企业产品溶出曲线比较,可以看出2家企业产品在规定溶出时间内,溶出度不能达到限度要求,即建立方法可以有效区分因处方与生产工艺不同引起的产品质量差异,方法更具区分力。
因来氟米特为前药,口服吸收迅速,在胃肠黏膜与肝中迅速转变为活性代谢产物,来氟米特在血浆中的浓度很低,临床上均是检测其代谢产物的浓度。现有文献报道体内药代数据均为其代谢产物的相关信息,因无法获知来氟米特的转化途径,也无法获得来氟米特的代谢动力学数据,导致无法准确预测来氟米特代谢后的血药浓度曲线,而代谢产物的体内变化反应不了来氟米特在胃肠道中的溶解、溶出特征,致使无法建立来氟米特的体内外相关性。
REFERENCES
[1] QU C H, LI X Y, TAO L, et al. Severe bone marrow suppression accompanying acute episode of chronic cholecystitis due to leflunomide and methotrexate combination therapy [J]. Pharm Today(今日药学), 2016, 26(1): 51-53.
[2] LESLIE Z, BERNET F B, TUDOR I O. BDDCS applied to Over 900 Drugs [J]. AAPS J, 2011, 13(4): 519-547.
[3] 中国药典. 二部[S]. 2015, 附录: 462-463.
[4] USP39 [S]. 2016, NF: 4070.
[5] YE G J, QIN L H, HU Q H. Study on dissolution method for gefitinib tablets [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016, 33(6): 741-746.
[6] ZHENG S F, GUO W B, WANG Y, et al. Improved dissolution method of ioratadine tablets [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(2): 178-181.
[7] WANG X, TANG S F. Development and study of method for dissolution test of furazolidone tablets [J]. Chin J pharm Anal (药物分析杂志), 2010, 30(8): 1445-1447.
[8] GUO Y, Fu Y. Study on dissolution test of prulifloxacin tablets [J]. Chin J pharm Anal(药物分析杂志), 2008, 28(2): 321-322.
[9] MIAO H X, BAI Z Z, JIANG L G. Study on dissolution test of Nimdulide Tablets [J]. Drug standard China(中国药品标准), 2009, 10(6): 424-426
[10] ZHU P X, WEI W, LU X J, et al. Study of method for dissolution test of compound aminopyrine phenacetin tablets [J]. Chin J Mod Appl Pharm(中国现代应用药学),2017, 34(2): 272-275.
[11] MA W X, TANG C Y, LIU Q M, et al. Comparative study on the dissolution curves of Febuxostat Tablets [J]. J Pharm Res(药学研究), 2017, 36(2): 84-87.
(本文责编:蔡珊珊)
Improvement and Study for Dissolution Test of Leflunomide Tablets
Zhao Haiyun, Wang Song, Zhang Dongmei, Li Yujie, Yang Na, Ling Xiao*
(Shandong Institute For Food and Drug Control, Jinan 250101, China)
ABSTRACT:OBJECTIVETo improve the current method of dissolution test of leflunomide tablets.METHODSAfter a series of study on the dissolution meidium, rotate speed and samplingtime, the paddle method was used with0.5% sodium laurysulfate as the dissolution medium at a rotate speed of 75 r·min-1, dissolution time was 45 min. Then it was determined by HPLC with detection wavelength of 210 nm, calculated dissolution with peak area according to the external standard, finally carried out the methodology validation for the established method.RESULTSThe validation result showed that the linear range of leflunomide was 0.57-14.3 μg·mL-1,Y=72.157X+2.7486,R2=1, The average recovery was 98.7%. The established method can distinguish one company’s product form another while the product from the same company have a good uniformity dissolution.CONCLUSIONThis method can be useful and convenient without using the organic solvent as dissolution medium in the pharmaceutical method, it can be applied to determine dissolution of leflunomide tablets.
KEY WORDS:Leflunomide tablets; dissolution; HPLC
中图分类号:R917.101
文献标志码:B
文章编号:1007-7693(2017)11-1560-04
DOI:10.13748/j.cnki.issn1007-7693.2017.11.013
引用本文:赵海云, 王松, 张冬梅, 等. 来氟米特片溶出度方法的改进研究[J]. 中国现代应用药学, 2017, 34(11): 1560-1563.
基金项目:山东省重点研发计划项目(2016ZDJS07A04)
作者简介:赵海云,女,硕士,主管药师 Tel: (0531)81216550 E-mail: helen8204@126.com
*通信作者:凌霄,女,博士,副主任药师 Tel: (0531)81216551 E-mail: Xiaol6551@126.com
收稿日期:2017-03-19