李鑫,郭凌阁,邓蕾,冮怡琳,张琦,赵莹莹
(哈尔滨商业大学药学院,哈尔滨 150076)
摘要:目的将硝苯地平制备成微乳,以提高其生物利用度。方法利用透射电镜以及Zeta电位测定仪等技术检测硝苯地平自微乳的平均粒径及粒径分布、形态特征、表面电位、稳定性、药物的体外释放以及体内的吸收等特点,并进行初步质量评价研究。结果所制得的硝苯地平自微乳平均粒径为25~26 nm,分布较为集中;粒子形态圆整,大小均匀;表面电位为-(25.1±1.1)mv;体外释放度>90%。结论将硝苯地平制成自微乳,药物在体内有良好的吸收。
关键词:硝苯地平;自微乳;质量评价
硝苯地平属于二氢吡啶类钙离子拮抗剂,是临床上治疗高血压、心绞痛等心血管疾病的首选药物之一[1-3]。硝苯地平作为钙离子拮抗剂可以使心肌细胞的收缩力减弱,心肌细胞对能量及氧的消耗减少,达到直接保护心肌细胞、治疗心绞痛和降血压的目的[4-6]。硝苯地平作为钙通道拮抗剂的代表药物,目前国内市场主要以片剂、胶囊、注射剂、滴丸等剂型应用于临床。但是硝苯地平存在水溶性差、生物利用度低等问题,现在的剂型还未能完全解决这些问题,因此本实验拟采用自微乳化药物传递系统以提高硝苯地平原料药的溶解度。
自微乳化药物传递系统(self microemulsion drug delivery system,SMEDDS)是由主药、油相、乳化剂、助乳化剂形成的透明均一的液体剂型或固体剂型[7]。SMEDDS是难溶性药物的理想载体,具有毒性小、安全系数高、制备简单、可以增大药物溶解性、提高药物稳定性等优点[8]。
本实验制备硝苯地平自微乳,通过测定微乳的粒径和Zeta电位来评价乳化效果及其稳定性,采用HPLC测定大鼠体内硝苯地平含量来确定硝苯地平自微乳在大鼠体内吸收效果,并与硝苯地平普通制剂进行比较。
硝苯地平原料药(同时作为对照品使用,西安藻露堂生物科技有限公司,批号:131102,含量≥99%);油酸乙酯(上海三齐医药科技有限公司,批号:20130214);CremophorRh-40(阿拉丁化学试剂有限公司,批号:20120902);Transcutol P(天津基准化学试剂有限公司,批号:20130627);蒸馏水:实验室自制。氨氯地平(阿拉丁化学试剂有限公司,批号:A123260,纯度≥98%)。
AUTO-SCIENCE型超声波清洗仪(上海黄海药检仪器厂);SL102N型电子天平(上海民桥精密科学仪器有限公司);XK 96-A型快速混匀器(姜堰市新康医疗器械有限公司);79-Z型双向恒温磁力搅拌器(江苏省金坛市荣华仪器制造有限公司)。Bettersize 2000型激光粒度分析仪(丹东百特仪器有限公司);L7-DDW型Zeta电位测定仪(深圳市雷祺电子科技有限公司)。
Wistar SD大鼠,清洁级,来源于长春市亿斯实验动物技术有限责任公司,合格证号:SYXK(黑)2016-004,体质量为180~220 g,年龄为2个月左右。
准确称取硝苯地平原料5 g充分研细,过120目筛备用。然后对其油相、乳化剂以及助乳化剂进行优化处方筛选。取最佳比例的处方量的辅料CremophorRh-40-Transcutol P-油酸乙酯(45∶25∶30),油酸乙酯150 g、CremophorRh-40 225 g、Transcutol P 125 g放置于适宜的容器中,在37 ℃的环境下,使用磁力搅拌(300 r·min-1),搅拌30 min,使充分溶解均匀,后在37 ℃水浴中平衡24 h,过胶体磨研匀,即得硝苯地平自乳化药液[9](以上均严格避光操作)。
2.2.1 形态表征 取自制的硝苯地平-SMEDDS,经稀释100倍后用肉眼观察其状态。通过用透射电镜观察其体态特征。
2.2.2 黏度表征 取自制硝苯地平-SMEDDS适量,在室温(25 ℃)下用旋转式黏度计测其黏度,检测是否符合自微乳制剂的范围(以上均严格避光操作)。
2.2.3 粒径测定 是否已形成微乳的绝对标准是用粒径来衡量的,粒径的分布是评价所制备的微乳是否稳定的最重要性质之一[10]。当粒径在1~ 100 nm之间的液滴所形成的乳液才是微乳。取自制硝苯地平-SMEDDS制剂,加水稀释100倍以后,采用Bettersize 2000型激光粒度分析仪测定硝苯地平-SMEDDS自乳化以后的粒径(以上均严格避光操作)。
2.2.4 Zeta电位测定 Zeta电位与胶态分散的稳定性相关[11]。Zeta电位是对颗粒之间相互排斥或吸引力的强度的度量[12]。只有同电荷微粒间范德华力达到平衡时微粒体系才能稳定。取自制硝苯地平-SMEDDS制剂,加水稀释100倍以后,采用L7-DDW型Zata电位测定仪测定Zeta电位(以上均严格避光操作)。
2.3.1 硝苯地平-SMEDDS稳定性测定 将自制的硝苯地平-SMEDDS置于高速离心机中,于15 000 r·min-1离心25 min,观察外观性状,是否有分层,颜色、澄清度是否改变等。室温避光条件下放置3个月,15 000 r·min-1离心25 min,观察外观性状,是否分层,颜色、澄清度是否改变等。
2.3.2 硝苯地平-SMEDDS体外释放度测定 将自微乳药液装入自制的软胶囊中(每粒约含 5 mg 硝苯地平),本品(10粒)与市售片剂(10 片)照中国药典2015年版第四部第一法[13],分别以300 mL蒸馏水、pH 6.8的缓冲液和 0.1 mol·L-1盐酸为溶出介质,转速为 100 r·min-1,温度为37 ℃,并分别于5,10,15,20,25,30,45 min 时,取溶出液5 mL(同时补充新鲜介质),加甲醇稀释至10 mL,使用0.22 μm微孔滤膜滤过,量取20 μL注入液相色谱仪分析其浓度,色谱条件为色谱柱是ODS C18(4.6 mm×250 mm,5 μm),流动相是甲醇-水(60∶40),柱温25 ℃,流速1.0 mL·min-1。测定波长235 nm(波长的确定是用硝苯地平供试品在200~400 nm处进行紫外全波长扫描得到的最大吸收峰),进样量20 μl,计算其累积释放度,以考察不同溶出介质对其溶出度的影响[14-15]。
2.3.3 硝苯地平-SMEDDS在体内的药物吸收性能测定 取2组各12只大鼠[♀♂各半,体质量(250±30)g],禁食10 h以上,于次日晨1组给予空腹自制硝苯地平-SMEDDS(相当于硝苯地平原料5 mg),另1组给予市售的硝苯地平,给药2 h后可饮水,4 h后统一进食。于灌胃后的0.5,1,2,4,8,12,24 h对2组大鼠进行尾静脉取血约2 ml,放置于由肝素钠处理过的干燥离心管中。在10 000 r·min-1的条件下离心12 min分离血浆,-20 ℃贮存。精密量取血浆500 μl,加入甲醇-水(1∶1)50 µl,内标溶液(179.82 ng·mL-1氨氯地平溶液)50 µl,1 mol·L-1氢氧化钠溶液500 µl,涡旋1 min,加入乙醚-正己烷混合液(3∶1)3 ml,振荡10 min(6档),离心5 min(15 000 r·min-1),取上层有机相置另一试管中,于40 ℃水浴中空气流下吹干。残留物以乙腈-水(1∶1) 200 µl复溶,涡旋混合1 min,移至1.5 ml离心管中,离心5 min (15 000 r·min-1),取上清液30 µl进样分析(以上均严格避光操作)。采用HPLC测定自制硝苯地平-SMEDDS和市售硝苯地平的血药浓度。
3.1.1 油相的选择 分别将4 g的橄榄油、氢化玉米油、油酸乙酯、MCT置于4只试管中,将适量的硝苯地平加入到试管中,涡旋振荡,观察硝苯地平的溶解过程,如肉眼不见硝苯地平的颗粒,则继续加入,至有多余硝苯地平沉淀为止。接着恒温振荡48 h后取适量,在10 000 r·min-1的条件下离心20 min。取上清液用流动相稀释100倍。用HPLC测定硝苯地平的溶解度分别为0,0,6.19,3.33 mg·mL-1。硝苯地平在油酸乙酯中的溶解度相对比较大,初步确定油酸乙酯为处方的油相。
3.1.2 乳化剂的选择 分别将4 g的Cremophor Rh-40,CremophorEL,Tween 80置于3只试管中,将适量的硝苯地平原料药加入到试管中,涡旋振荡,观察硝苯地平的溶解过程,如肉眼不见硝苯地平的颗粒,则继续加入,至有多余硝苯地平沉淀为止。接着恒温振荡48 h后取适量,在10 000 r·min-1的条件下离心20 min。取上清液用流动相稀释100倍。用HPLC测定硝苯地平的溶解度分别为14.16,7.15,11.07 mg·mL-1。硝苯地平在Cremophor Rh-40及Tween 80中的溶解度比较大,因此初步确定Cremophor Rh-40为处方的乳化剂。
3.1.3 助乳化剂的选择 分别将5 ml的正丁醇,Transcutol P,丙三醇置于3只试管中,将适量的硝苯地平原料药加入到试管中,涡旋振荡,观察硝苯地平的溶解过程,如肉眼不见硝苯地平的颗粒,则继续加入,至有多余硝苯地平沉淀为止。接着恒温振荡48 h后取适量,在10 000 r·min-1的条件下离心20 min。取上清液用流动相稀释。用HPLC测定硝苯地平在各助乳化剂中的溶解度分别为12.07,20.04,0.51 mg·mL-1。硝苯地平在正丁醇及Transcutol P中的溶解度比较大,因此初步确定为Transcutol P处方的助乳化剂。
3.1.4 最佳处方筛选 首先将筛选的乳化剂CremophorRh-40与助乳化剂正丁醇,Transcutol P分别按Km=2∶1的比例的混合,与确定的油相油酸乙酯再按照1∶9,2∶8,3∶7,4∶6,5∶5,6∶4,7∶3,8∶2,9∶1的比例混匀,取上述混合物1 g在37 ℃恒温中速磁力搅拌条件逐滴加水,记录形成微乳时各组分的质量百分含量。
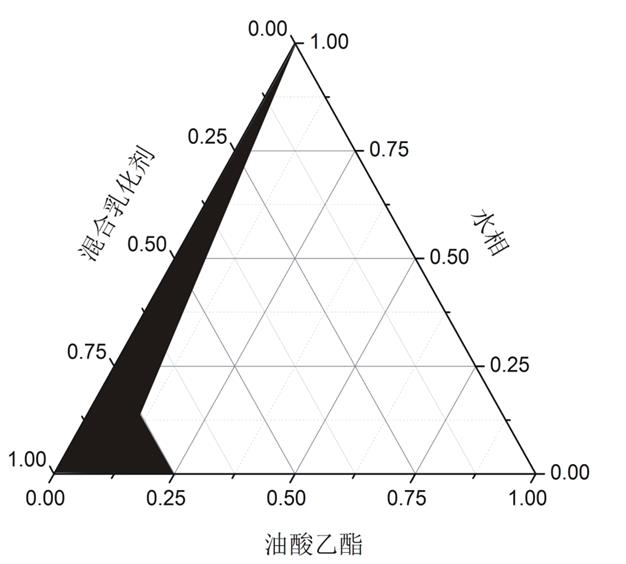
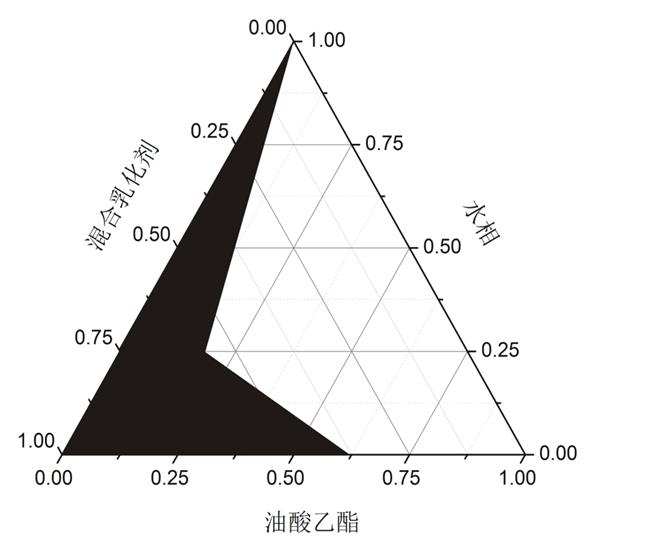
以油相、乳化剂与助乳化剂混合物,水为3个顶点,绘制伪三元相图,确定微乳区域。以所成微乳区域的大小来确定助乳化剂,所绘制伪三元相图如图1阴影区域为微乳区。
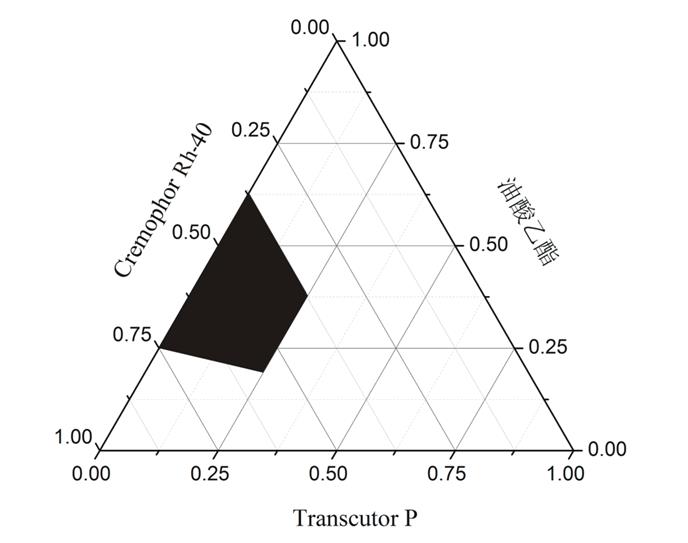
空白SMEDDS三元相图的绘制:将CremophorRh-40、Transcutol P、油酸乙酯作为三元相图的3个顶点,将CremophorRh-40与Transcutol P按Km=2∶1的比例的混合,与确定的油相油酸乙酯按照1∶9,2∶8,3∶7,4∶6,5∶5,6∶4,7∶3,8∶2,9∶1的比例混匀,各取上述混合溶液l g,加入到100 ml蒸馏水中,从外观上观察,将能形成澄明溶液的处方点确定为三元相图中可形成自微乳的区域点,结果见图1。
如图1中阴影区域中的任意点的组成比例加水后都可形成自微乳。图中显示油相含量可达到40%,但是考虑到处方中如果油相比例太接近临界点,剂型受环境影响会变化明显,不易储存,因此处方选择油相的比例为30%。

A
B
C
图1 三元相图
A-助乳化剂(正丁醇)Km=2∶1;B-助乳化剂(Transcutol P)Km=2∶1;C-空白SMEDDS三元相图。
Fig. 1 Three element phase diagram
A-co-emulsifier(N-butanol)Km=2∶1; B-co-emulsifier(Transcutol P)Km=2∶1; C-blank SMEDDS.
处方优化:在上述选定的基础处方(油相:油酸乙酯,乳化剂:CremophorRh-40,助乳化剂:Transcutol P)上,油相百分含量确定为30%。将乳化剂与助乳化剂按照65∶5,60∶10,55∶15,50∶20,40∶30,35∶35,30∶40,25∶45,20∶50,15∶65,10∶60,5∶65(百分含量比),配制空白SMEDDS,中速磁力搅拌均匀后,分别加入过量的硝苯地平原料,室温条件下恒温震荡48 h,静置24 h,取上清液适量,过0.8 μm的微孔滤膜,取滤液用粒径分析仪测定粒径。同时取上清液适量,过0.45 μm的微孔滤膜,用流动相稀释后,用HPLC测定硝苯地平在SMEDDS中的溶解度,每个浓度进样3次。数据记录如表1。
表1 处方优化实验结果(n=3)
Tab. 1 Experimental results of prescription optimization (n=3)
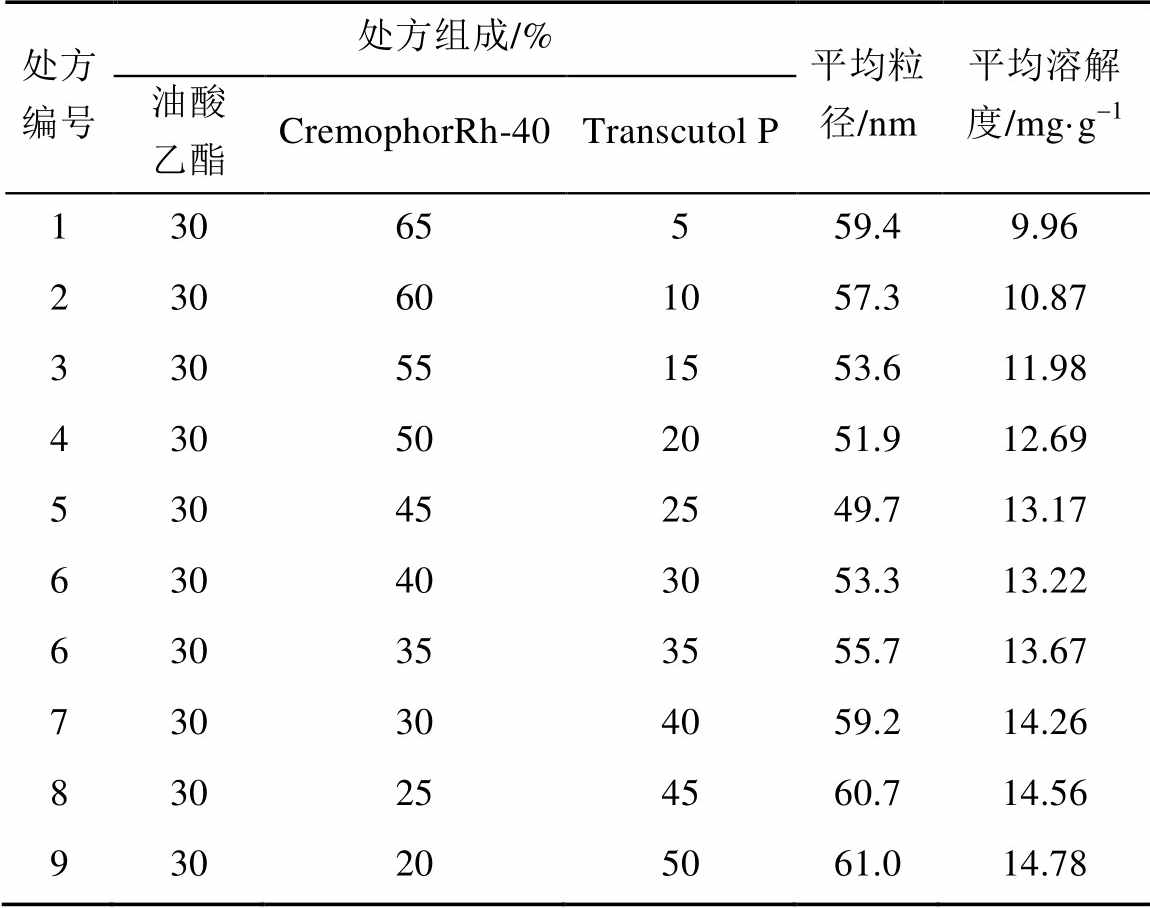
由表1可以看出,随着处方中助乳化剂Transcutol P比例的增加,硝苯地平的溶解度逐渐增加,同时考虑到硝苯地平在处方中的含量应该在溶解度以下,否则受储存环境影响硝苯地平有可能会析出,从而影响硝苯地平-SMEDDS的稳定性。目前市售硝苯地平制剂剂量是5,10 mg,同时便于生产投料及患者服药。确定硝苯地平-SMEDDS中硝苯地平含量的质量分数为1%;随着助乳化剂Transcutol P比例增加,微乳平均粒径呈逐渐减小的趋势,但助乳化剂质量分数高于25%平均粒径又开始呈逐渐增大趋势。因此确定空白体系的最佳组成为CremophorRh-40-Transcutol P-油酸乙酯)=45∶25∶30。
3.2.1 形态表征 室温下,自制的硝苯地平-SMEDDS为淡黄色,流动性良好。体外乳化后则为带淡蓝乳光均一透明的液体,加水稀释后溶液为澄清、透明的淡蓝色溶液,结果见图2;所制微乳呈大小均匀的圆球型,结果见图3。
图2 稀释后的硝苯地平自微乳化液
Fig. 2 After dilution of nifedipine microemulsion

图3 载药自微乳TEM粒径照片
Fig. 3 Drug loaded microemulsion TEM particle size photographs
3.2.2 黏度表征 自制硝苯地平-SMEDDS适量,在室温(25 ℃)下用旋转式黏度计测其黏度为45.0 mPas,当温度上升至37 ℃时黏度为24.5 mPas,在室温(25 ℃)下流动性较好[14]。
3.2.3 粒径测定 取3批自制硝苯地平-SMEDDS制剂,分别稀释100倍以后,采用Bettersize 2000型激光粒度分析仪测定硝苯地平-SMEDDS自乳化以后的粒径,结果见表2。结果显示3个批次的自制硝苯地平-SMEDDS稀释100倍所得微乳平均粒径为25.03,25.47,25.93 nm,在25~26 nm之间,分布较为集中。
表2 自制硝苯地平-SMEDDS和市售硝苯地平的药动学参数
Tab. 2 Pharmacokinetic parameters of nifedipine-SMEDDS and nifedipine on sale

3.2.4 Zeta电位测定 取3批自制硝苯地平-SMEDDS制剂,分别稀释100倍以后,采用L7-DDW型Zeta电位测定仪测Zeta电位。结果显示3个批次的自制硝苯地平-SMEDDS稀释100倍所得微乳平均Zeta电位为-(25.1±1.1)mv。
3.3.1 硝苯地平-SMEDDS稳定性测定 将自制的硝苯地平-SMEDDS置于高速离心机中,于15 000 r·min-1离心25 min,结果表明:其自制硝苯地平-SMEDDS外观淡黄色、流动性良好,无分层等影响稳定性的现象发生。
室温避光条件下放置3个月,15 000 r·min-1离心25 min,结果表明:其外观淡黄色、流动性良好,无分层等影响稳定性的现象发生。通过电位分布以及电镜检测纳米粒形态无明显变化,综合以上对粒径分析及Zeta电位的考察,证明硝苯地平-SMEDDS稳定性良好。
3.3.2 硝苯地平-SMEDDS体外释放度测定 溶出度曲线见图4~6。可以看出市售片剂在蒸馏水、pH 6.8缓冲液和0.1 mol·L-1盐酸中45 min内溶出量不到85%。自制硝苯地平-SMEDDS软胶囊在不同介质中15 min内就能达到完全溶出,且不受介质的影响。说明自制硝苯地平SMEDDS在胃肠道的释药速率显著高于市售片剂。由于SMEDDS制备简单,服用体积小,性质稳定,因此对于水溶性小的药物来说,是一种极具开发前景的新技术。
3.3.3 硝苯地平-SMEDDS在体内的药物吸收性能测定 通过采用“2.3.3”的方法,测定市售片剂硝苯地平和自制硝苯地平-SMEDDS单次给药后大鼠的经时血浆药物浓度数据见图7。
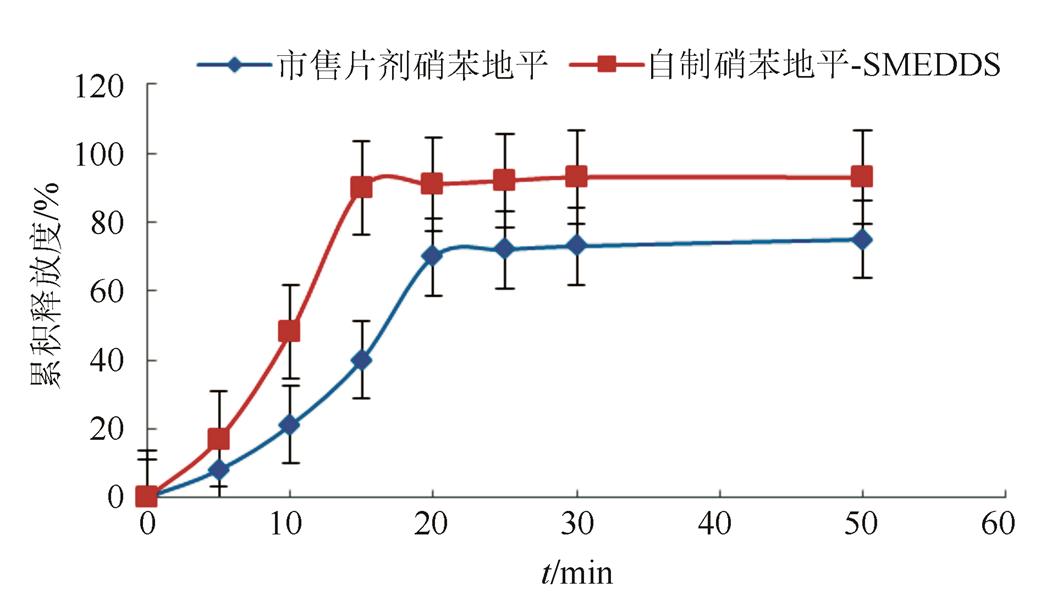
图4 SMEDDS和片剂在蒸馏水中的溶出曲线
Fig. 4 Dissolution curves of SMEDDS and tablets in distilled water
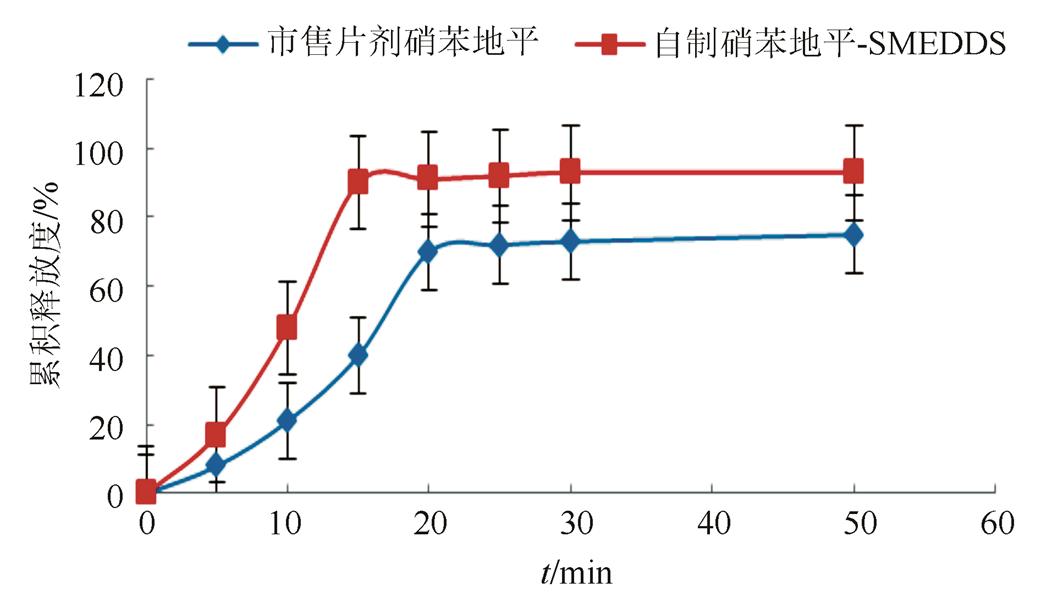
图5 SMEDDS和片剂在pH 6.8缓冲液中的溶出曲线
Fig. 5 Dissolution curves of SMEDDS and tablet in pH 6.8 buffer

图6 SMEDDS和片剂在0.1 mol·L-1盐酸中的溶出曲线
Fig. 6 Dissolution curves of SMEDDS and tablets in 0.1 mol·L-1HCl
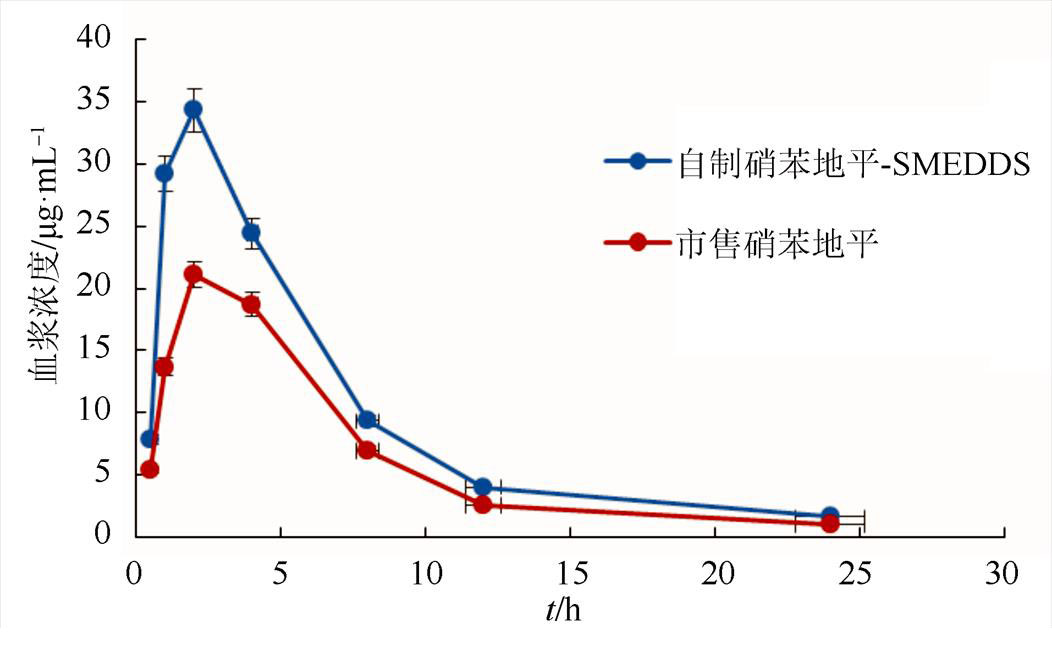
图7 市售硝苯地平与自制硝苯地平-SMEDDS药时曲线
Fig. 7 Pharmacokinetic time curve of commercially available nifedipine and homemade nifedipine-SMEDDS
通过对硝苯地平-SMEDDS和市售硝苯地平药动学参数对比,可以看出硝苯地平-SMEDDS的末端消除半衰期(T1/2)、药峰浓度(Cmax)、药时曲线下面积(AUC)大于市售的硝苯地平,表明硝苯地平-SMEDDS在体内血药浓度下降时所需要的时间长,在体内的血药浓度大,药效时间长。而硝苯地平-SMEDDS达峰时间(Tmax)小于市售的硝苯地平,表明药物进入体内达到药峰浓度时间短,起效快。由以上数据和图表结果表明,自制硝苯地平-SMEDDS在大鼠体内吸收比市售的硝苯地平要好,在体内的血药浓度较高,并且具有一定的缓释作用。
自制的硝苯地平-SMEDDS的平均粒径为25~26 nm,形态圆整,大小均匀,且具有良好的流动性,平均Zeta电位在-(25.1±1.1)mv,具有很好的粒度稳定性,其溶出度也快于普通的片剂剂型,易于快速吸收。在大鼠体内测试表明达峰时间较快,半衰期维持持久,药峰浓度相对较大,因此具有良好的效果。
REFERENCES
[1] 陈睿. 三种硝苯地平口腹制剂一致性评价[D]. 山东大学, 2013.
[2] 胡冬梅. 二氢吡啶类钙拮抗剂研究的新进展[J]. 中国医疗前沿, 2010, 5(13): 12-13, 74.
[3] 陈国华, 王丽, 姚秀梅, 等. 新型二氢吡啶类钙拮抗剂化合物的合成与生物活性[J]. 有机化学, 2010, 30(7): 997-1004.
[4] 刘翠莲. 反复鼻出血98例的治疗体会[J]. 中外健康文摘, 2013(47): 77.
[5] 吴利群. 哺乳期子宫上环术中出血的临床治疗效果观察[J]. 中外女性健康, 2013(8): 79-80.
[6] 硝苯地平控释片具有卓越的抗动脉粥样硬化作用[J]. 世界核心医学期刊文摘.心脏病学分册, 2010(9): 55-59.
[7] 张娜, 康虞玲, 刘智勤, 等. 自微乳化药物传递系统的应用与进展[J]. 中国医院药学杂志, 2010, 30(11): 960-962.
[8] 黄源锐. 难溶性药物固体自乳化释药系统的研究[D]. 重庆医科大学, 2013.
[9] 罗丽. 硝苯地平微乳的制备及质量评价[D]. 重庆大学, 2013.
[10] Charman S S, Charman W N, Rogge M C, Self-emulsifying drug delivery system:formulation and biopharmaceutic evaluation of an investigation lipophilic compound [J]. Pharm Res, 2014, 37(5): 83-89.
[11] 田霞. 联苯双酯过饱和自微乳制剂的研究[D]. 吉林大学, 2011.
[12] 唐静怡. (S)-萘普生反酯的合成、脂水分配系数测定及相关活性研究[D]. 中南大学, 2003.
[13] 中国药典. 四部[S]. 2015: 121.
[14] Gursoy R N, Benita S. Self-emusifying drug delivery systems for improved oral delivery of lipophilic drugs [J]. Biomed Pharmacother, 2004, 58(3): 173-182.
[15] Noda M, Shibouta Y, Inada Y, et al. Inhibition of rabbit aortic angiotensin receptor by CV-11974, a new nonpeptide AII antagonist [J]. Biochen Pharmacol, 2011, 46(2): 311-318.
(本文责编:曹粤锋)
Study on the synthesis and properties of nifedipine self microemulsion system
Li xin, GUO Lingge, Deng lei, GANG yilin, Zhang qi, Zhao yingying
(Harbin University of Commerce college of pharmacy, Harbin 150076, China)
ABSTRACT:OBJECTIVETo improve the bioavailability of nifedipine by the preparation of micro-emulsified.METHODSUsing transmission electron microscope and Zeta potential analyzer for the average particle of nifedipine self microemulsion size and particle size distribution, morphological characteristics, surface potential, stability, releasein vitroand absorptionin vivocharacteristics of initial quality evaluation.RESULTSThe average diameter size of nifedipine self-emulsion was 25~26 nm. The average particle the distribution was more concentrated; particle shape, uniform size; surface potential was –(25.1+1.1)mv; thein vitrorelease rate was >90%.CONCLUSIONThe drug has made nifedipine self-emulsion which has good absorptionin vivo.
Key wordS:nifedipine, self-emulsion, quality evaluation
中图分类号:R943
文献标志码:B
文章编号:1007-7693(2017)11-1576-06
DOI:10.13748/j.cnki.issn1007-7693.2017.11.017
引用本文:李鑫, 郭凌阁,邓蕾, 等. 硝苯地平自微乳的性能研究[J]. 中国现代应用药学, 2017, 34(11): 1576-1581.
作者简介:李鑫,男,硕士,副教授 Tel: 13603602001 E-mail:lixin@hrbcu.edu.cn
收稿日期:2017-03-13