表1 常规分析方法学参数
Tab. 1 Methodological parameters of conventional analysis
应旭辉,李静慧,孔万明,李董,刘雳*
(正大青春宝药业有限公司研究院,杭州 310023)
摘要:目的 利用近红外光谱(near infrared spectroscopy,NIR)技术对红参药材中的水分、人参皂苷和糖类成分进行快速分析,实现红参药材质量的快速评价。方法 用62批红参样品作为校正集,分别建立水分、人参皂苷和糖类成分的定量模型,对模型进行系统的优化,并用另外38批样品作为验证集对建立的模型进行验证和评价。结果 所建的模型对红参水分含量、人参皂苷Rg1和Re总含量、人参皂苷Rb1含量及麦芽糖和蔗糖总含量均有较好的预测能力,预测相对偏差均<15%,所建NIR快速检测方法的精密度和重复性结果均较好。结论 该方法可以对红参药材的关键质控指标进行快速检测,结果可靠,是对传统分析方法的有效补充,可以有效地指导后道工序的生产,从而避免因药材质量不合格而造成不必要的浪费。
关键词:红参;近红外光谱;快速质量评价;掺糖分析
近红外光谱分析法具有样品前处理简单,分析快速等优点,是一种绿色环保无污染的分析方法,已在中药质量控制中得到较为广泛的应用[3-4]。目前,国内外已有一些报道开始尝试用近红外光谱技术对红参进行快速质量评价,但是分析的指标往往比较单一,不能全面有效地反映红参整体内在质量,例如进行真伪鉴别的简单定性分析[1]、水分含量测定[5-6]、人参皂苷含量测定[7]。
为了克服传统分析方法费时、繁琐和污染的缺点,现有近红外光谱法指标成分单一以及目前糖类成分含量无法有效控制的问题,本研究基于近红外光谱法拟建立一种对红参中水分、糖类成分以及人参皂苷的含量快速检测方法,用于快速判断红参样品的质量以及辨别样品是否掺糖,从而最大可能地保障红参药材的质量。
Agilent 1200型高效液相色谱仪配紫外检测器及蒸发光散射检测器(美国Agilent);十万分之一精密分析天平(德国赛多利斯集团);Antaris MX傅立叶近红外仪配备便携式光纤(美国 Thermo);KQ-250DB型数控超声波清洗仪(昆山市超声波仪器有限公司);超纯水仪(美国密理博公司)。
收集100批红参药材样品(其中92批样品来自正大青春宝药业有限公司,主要采购于吉林抚松县、长白镇和集安市;其余 8批样品为普通市售红参,产地为吉林集安、靖宇、万良和延边),所有红参样品经正大青春宝药业有限公司质量部原辅料组汪永斌工程师鉴定;人参皂苷 Rg1(批号:110703-201326)、Re(批号:110754-201324)、Rb1(批号:110704-201321)均为供含量测定用,购于中国药品生物制品检定所;蔗糖(分析纯,批号:20110210,上海强顺化学试剂有限公司);麦芽糖(生化试剂,批号:1011017,上海展云化工有限公司);无水乙醇(分析纯,杭州双林化工试剂厂);水为Millipore超纯水仪制备的超纯水;乙腈(色谱纯,德国默克);甲醇(色谱纯,美国天地)。
2.1 各指标常规方法分析
2.1.1 水分含量测定 水分的含量按照中国药典2015年版通则0832第二法进行测定[8]。取红参药材粉末(过6号筛)约2 g,平铺于干燥至恒重的扁形称量瓶中,精密称定,打开瓶盖在 100~105 ℃干燥5 h,将瓶盖盖好,移置干燥器中,冷却30 min,精密称定,再在上述温度干燥1 h,冷却,称重,至连续2次称重的差异≤5 mg为止。根据减失的质量,计算供试品中含水量(%)。
2.1.2 人参皂苷含量测定 取红参药材粉末(过 6号筛)约1 g,置于50 mL锥形瓶中,加入70%乙醇 25 mL,轻微摇晃使粉末分散开,超声提取30 min,停顿10 min,轻微摇晃,再超声15 min。提取液离心后用0.45 μm膜滤过,取续滤液,即得供试品,注入液相色谱仪测定含量。取同一供试品连续进样 6次考察精密度。取同一批次红参药材,重复制备 6份供试品,进行重复性考察。另取一份样品,分别在 0,2,4,6,12,18,24 h进样,考察供试品溶液的稳定性。
分别精密称取人参皂苷Rg1、人参皂苷Re和人参皂苷Rb1对照品适量,加甲醇制成每1 mL中含人参皂苷Rg10.7 mg、人参皂苷Re 0.5 mg、人参皂苷Rb10.8 mg的混合溶液,作为储备液,然后再用甲醇稀释成系列对照品溶液,分别注入液相色谱仪,以对照品浓度为横坐标(X),以色谱峰面积为纵坐标(Y)进行线性回归,绘制标准曲线。
取 3份已知皂苷含量的同一批次红参样品约1 g,加入上述混合对照品储备液1 mL,然后按供试品制备方法制备,并测定含量,考察加样回收率。
分析色谱柱为 Agilent SB-C18(4.6 mm×250 mm,5 μm),以乙腈(A)-水(B)为流动相,检测器为VWD紫外检测器,检测波长为203 nm,流速为 1 mL·min-1,洗脱梯度:0~25 min,21% A;25~45 min,21%→40% A;45~50 min,40%→95% A;50~60 min,95% A;60~63 min,95%→21% A;63~70 min,21% A。分析时柱温保持30 ℃。样品进样量为20 μL。用标准曲线法进行含量计算,结果以干燥品计(%)。
2.1.3 糖类成分含量测定 取红参药材粉末(过 6号筛)约0.5 g,置于50 mL锥形瓶中,加入30 mL纯化水,轻微摇晃使粉末分散开,超声提取30 min,停顿10 min,轻微摇晃,再超声15 min,提取液离心后用0.45 μm膜滤过,取续滤液,即得供试品溶液。取同一供试品溶液连续进样 6次考察仪器精密度。取同一批次红参样品,重复制备 6份供试品溶液,进行重复性考察。另取一份供试品溶液,分别在0,2,4,6,12,18,24 h进样,考察供试品溶液的稳定性。
精确称取蔗糖和麦芽糖对照品(五氧化二磷减压干燥器中干燥>12 h)适量,加水制成每1 mL含蔗糖11 mg及麦芽糖4 mg的对照品溶液,摇匀,作为储备液,然后稀释成一系列浓度的混合对照品溶液,分别注入液相色谱仪,以对照品进样量的对数为横坐标(X),以色谱峰面积的对数为纵坐标(Y)进行线性回归,绘制标准曲线。
取 3份已知糖成分含量的同一批次红参样品约0.5 g,加入上述混合对照品储备液1 mL,然后按供试品制备方法制备,并测定含量,考察加样回收率。
分析色谱柱为Alltech Prevail Carbohydrate ES(4.6 mm×250 mm,5 μm),流动相为乙腈-水溶液(75∶25),流速为1.0 mL·min-1,柱温保持在30 ℃,检测器为蒸发光散射检测器,每个样品进样量为10 μL,用标准曲线法进行含量计算。
2.2 近红外光谱法分析
2.2.1 近红外光谱采集 取约30 g红参药材粉末(过6号筛)置于50 mL西林瓶中(粉末装量过半),轻轻敲打至粉末紧密严实,将便携式光纤插入样品粉末中,用仪器配套的 Result软件进行近红外光谱采集,检测温度为 19~32 ℃,检测湿度为20%~40%,光谱扫描范围为10 000~4 000 cm-1,每次光谱采集共扫描32次,分辨率为8 cm-1。每个样品的光谱自动采集 3次,取自动生成的平均光谱用于建模。
2.2.2 定量校正模型的建立及优化 将所有 100份红参样品随机分成2组,其中一组62份样品作为校正集,用于校正模型的建立;另外一组38份作为验证集,对建立的模型进行验证和评价。使用Unscrambler软件(9.8版)进行模型的建立,以决定系数(R2)和留一法交叉验证误差均方根(RMSECV)为模型评价指标,分别选取各模型组中R2最接近1且RMSECV最接近0的模型,得到各指标最佳定量校正模型[9]。
2.2.3 定量校正模型的评价 用已经建立的各指标定量模型预测验证集样品各指标含量,并与实际测定值比较,结果用预测误差均方根(RMSEP)和相对偏差表示,RMSEP和相对偏差越小,说明模型的预测能力越好。
2.2.4 近红外分析方法学考察 用 614006701-1批次样品,光纤探头插入样品后,连续扫描6次,用建立的模型预测各指标含量,进行精密度考察,结果用相对标准差(RSD%)表示;取 614007702-3批次样品,分成6份样品,重复测定6次,用建立的模型预测各指标含量,进行重复性考察,结果用相对标准差(RSD%)表示;取 614006702-4批次样品,每半个月进行1次近红外光谱扫描,连续跟踪3个月,并用已建立的模型预测各指标含量,进行重现性考察,结果用相对标准差(RSD%)表示。
3.1 常规化学分析方法
基于中国药典红参质量控制标准[2]以及相关文献报道[7,10],建立并优化了常规化学分析方法。红参人参皂苷类成分HPLC-UV色谱图见图1,糖类成分HPLC-ELSD色谱图见图2。从色谱图可见所有指标成分在该分析方法下均可以得到较好的分离。常规分析方法学考察结果见表1,结果显示,除人参皂苷Re和麦芽糖的R2略低外,其余指标R2均>0.999,表明各指标成分在线性范围内线性关系良好;各指标成分峰面积精密度均<5%,表明仪器精密度良好;除麦芽糖 RSD略高外,其余各指标成分峰面积重复性以及稳定性均<5%,表明方法重复性良好,供试品溶液在24 h内稳定;各指标成分加样回收率均>95%,表明方法准确度良好,测定结果可以作为参考值用于各指标近红外校正模型的建立。
表1 常规分析方法学参数
Tab. 1 Methodological parameters of conventional analysis


图1 红参人参皂苷HPLC-UV色谱图
A-标准品;B-红参样品;1-人参皂苷Rg1;2-人参皂苷Re;3-人参皂苷Rb1。
Fig. 1 HPLC-UV chromatograms of ginsenosides of Ginseng Radix et Rhizoma Rubra
A-standard; B-Ginseng Radix et Rhizoma Rubra sample; 1-ginsenoside Rg1; 2-ginsenoside Re; 3-ginsenoside Rb1.

图2 红参糖类成分HPLC-ELSD色谱图
A-标准品;B-红参样品;1-蔗糖;2-麦芽糖。
Fig. 2 HPLC-ELSD chromatograms of carbohydrate composition of Ginseng Radix et Rhizoma Rubra
A-standard; B-Ginseng Radix et Rhizoma Rubra sample; 1-sucrose;2-maltose.
因中国药典中红参含量测定要求是对人参皂苷Rg1和Re的总量进行控制,所以在结果中罗列了Rg1和Re总含量结果;同时国家食品药品监督管理总局新颁布的总还原糖检查项补充检验方法是对总还原糖进行含量控制,而蔗糖和麦芽糖是红参总还原糖测定中还原糖的主要来源,因此在结果中也罗列了蔗糖和麦芽糖的总含量,建模时以这 2个总含量作为指标。从结果可见,校正集和验证集样品各指标的含量范围基本相当,指标成分含量波动较大,这可能主要跟样品不同采收时间或产地有关[11-12]。糖类成分含量差异非常大,特别是蔗糖,含量从最低 5.06%到最高 39.24%,有多个批次的红参样品蔗糖含量明显偏高,存在掺糖的问题。王晶晶等[13]调查报告也显示,随着人参和红参价格增长,以次充好问题突出,其中红参最主要的问题就是加工过程掺糖。100批样品各指标的分析结果见表2。
表2 红参各指标成分的含量统计结果
Tab. 2 Statistical results of each index of Ginseng Radix et Rhizoma Rubra %

3.2 校正模型的建立及优化
近红外光谱分析结果的准确性受多种因素影响,因此需要在建模阶段对其进行优化。模型优化的参数主要包括波长范围、光谱预处理方法以及回归模型的选择,这些参数间相互影响,因此需要作系统的优化。波长范围主要考察 10 000~4 000 cm-1、10 000~4 250 cm-1和 7 500~4 250 cm-1这3个波段。其中10 000~4 000 cm-1为全波长,涵盖的信息最多。从红参近红外光谱图(图 3A)中可见图谱两端的区域(10 000~7 500 cm-1和4 250~4 000 cm-1)有一定噪音,其中4 250~4 000 cm-1波段的噪音可能是因为用于采集近红外光谱的光纤本身在4 500~4 000 cm-1有一定吸收[14]。因此需要考察含有噪音的波段是否对模型有影响。红参粉末颗粒大小不均匀或颗粒间隙会造成散射现象,同时也会经常出现图谱基线偏移或漂移的问题,因此在建模之前需要先对原始光谱进行预处理,消除因散射现象导致的近红外光谱基线漂移和噪音信号,从而提高模型的准确度和稳定性。最常用的光谱预处理方法主要包括多元散射校正(MSC)、标准正态变量变化(SNV)、一阶导数(1-Der)和二阶导数(2-Der),其中MSC可以有效地减少表面散射特性和光程变化对光谱的影响[15],1-Der和2-Der主要解决基线偏移或漂移的问题[16],而SNV既可以消除光散射的影响,又可以解决基线漂移的问题[17]。在建模中分别对这些算法进行了尝试。回归模型主要包括偏最小二乘回归(PLSR)、主成分回归(PCR)、多元线性回归(MLR)和人工神经网络(ANN)等方法,其中 MLR目前较为少用,而ANN主要用于非线性模型[18],因此在建模中主要对PLSR和PCR模型进行了考察。
将62份校正集样品的NIR光谱分别与各指标成分的测定值进行关联,通过对光谱预处理方法、波长选择及建模方式的综合考察,分别选取各模型组中R2最接近1且RMSECV最接近0的模型作为各指标的最佳校正模型,以水分定量模型的优化为例,见表3,经过比较,水分定量模型最佳条件为第21次测试结果,即原始光谱用SNV预处理,波长选取10 000~4 250 cm-1,用PLSR回归方式进行建模。校正集所有样品的原始近红外光谱及经SNV预处理后的近红外光谱见图3,各指标模型建立的参数见表4,其中主因子数是各模型经留一法交叉验证得到最小RMSECV时所对应的主成分数。相比其他预处理方法,用SNV对光谱进行预处理后可以有效地消除基线漂移和因散射等原因造成的噪音,效果最好;由于光纤本身吸收的干扰,在建模中需要排除4 250~4 000 cm-1波段,而10 000~7 500 cm-1波段虽然有一些噪音,但是同时包含有效的物质信息,这个波段被剔除后模型的误差反而会有所上升,线性也会略有下降,因此最后选择10 000~4 250 cm-1作为建模波长范围;回归模型的选择中,只有人参皂苷Rg1、Re以及两者总含量用PCR回归效果最好,其他指标均为PLSR回归效果更佳。另外,从结果也可以看出,用蔗糖、麦芽糖总含量以及人参皂苷Rg1、Re总含量作为指标进行建模,与各自单一指标进行建模时所得到的模型参数差异不大,为了便于与红参质量标准直接比较,最终采用该 2个总含量作为模型指标。
表3 不同预处理方法对水分定量校正模型性能的影响
Tab. 3 Influence of different pretreatment methods on performance of water calibration model
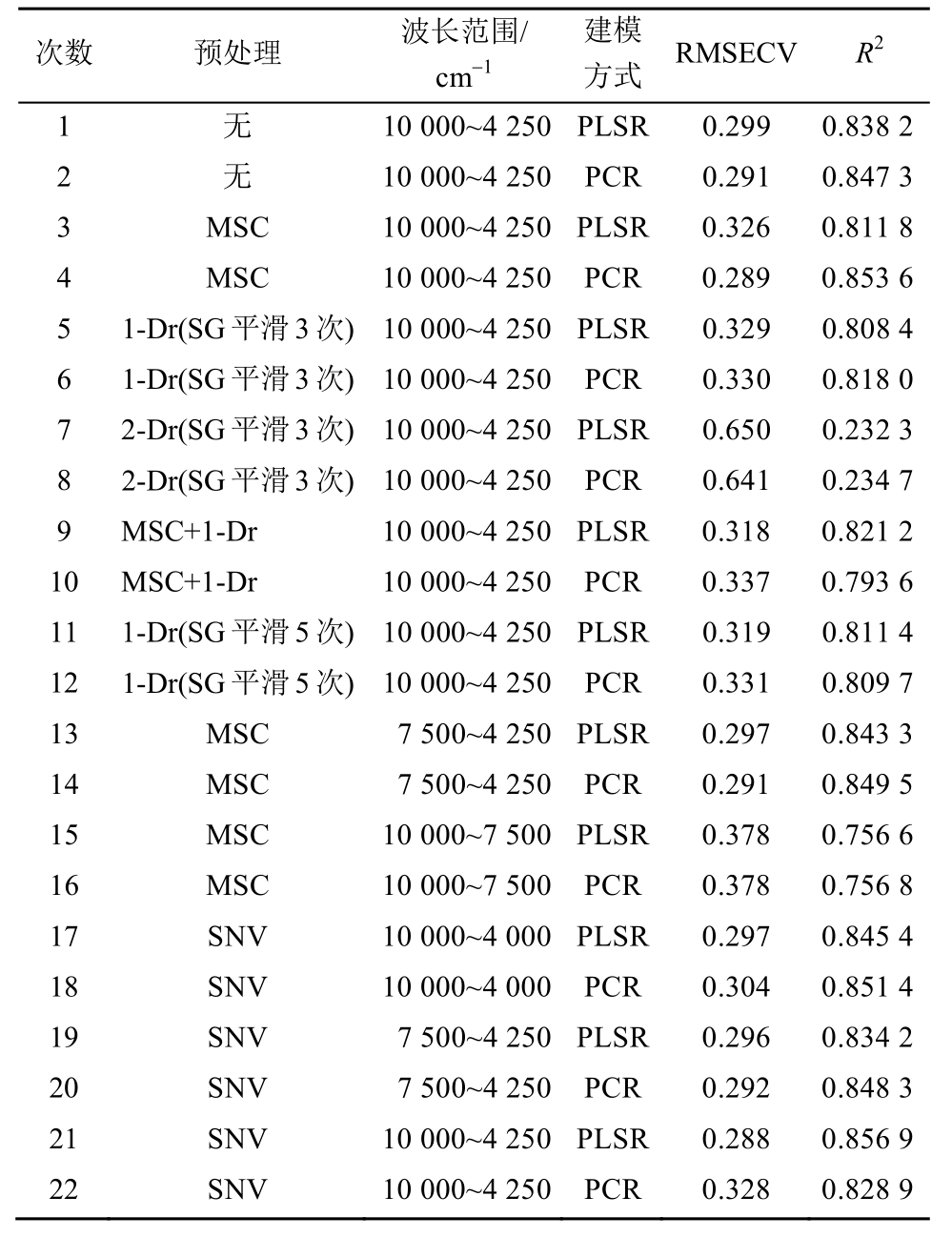
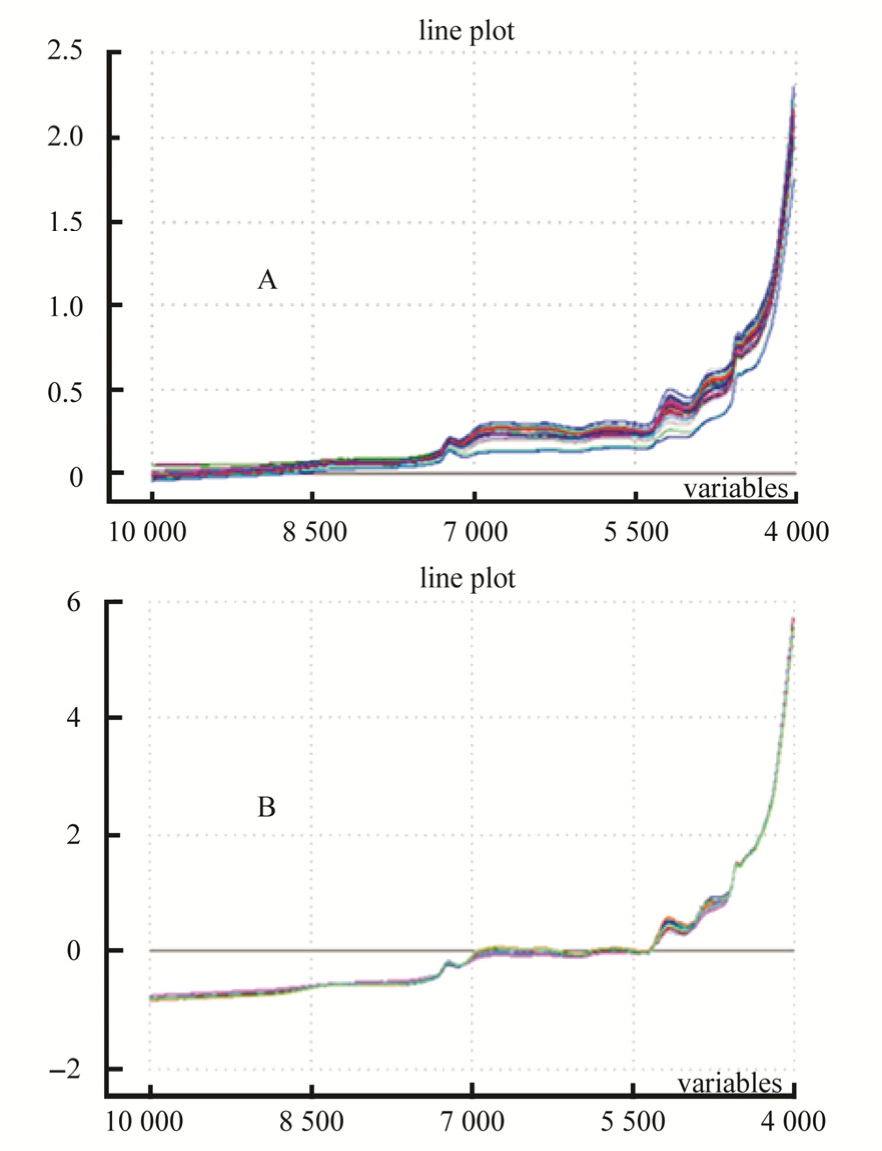
图3 校正集所有样品的近红外光谱图
A-原始光谱;B-SNV预处理。
Fig. 3 Near infrared spectroscopy spectra of calibration set
A-raw near infrared spectroscopy spectra; B-R spectra pretreated with SNV.
表4 各指标校正模型的具体参数
Tab. 4 Parameters of correction model for each index

在建模过程中发现,环境因素对近红外建模影响较大。虽然环境湿度对近红外光谱的采集影响较小[19],但是相对湿度过大,会导致粉末吸潮而影响分析结果的准确性[20]。由于用于分析的红参粉末样品颗粒较细,特别容易吸潮,因此环境相对湿度过大会对分析结果产生显著的影响,预测标准偏差会增加>50%。通过在打粉间和分析室安装除湿机后,得到明显改善。温度对近红外分析也有较大影响,这是由于近红外光谱是分子的能量光谱,因此温度的变化会导致光谱形状的变化,从而影响最后分析结果的准确性[21]。由于近红外建模需要采集的样品量大,时间跨度比较长,通常需要几个月甚至跨年,因此分析时的温度差异必然较大,即使分析室采用空调等设备,也无法保证环境温度在可控的小范围内波动。本研究在建模过程中,把温度作为影响模型建立的因素之一,参考相关文献报道的方法[22-23],在不同的温度下扫描样品光谱,使建模温度范围包含日常使用时的测量范围,这样建立的模型就具有温度的自动矫正功能,将温度的影响降到最低。
3.3 模型验证
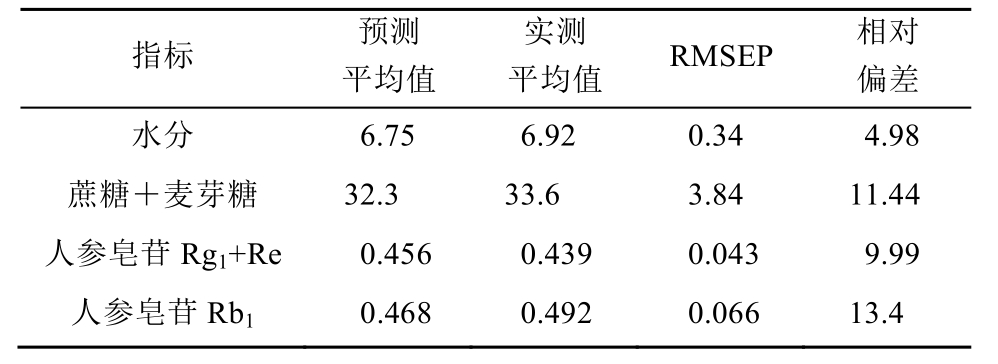
将 38份验证集样品的近红外光谱导入所建立的校正模型中,对各指标含量进行预测,并与实际测定值进行比较。各指标模型预测值与测定值相关性见图 4,从结果可见校正集样品和验证集样品较为均匀地分布在回归线两侧。模型预测结果整体评价见表 5,结果显示,目前建立的模型对红参水分含量、蔗糖和麦芽糖总含量、人参皂苷Rg1和Re总含量以及Rb1含量均有较好的预测能力,所有指标预测相对偏差均<15%,在可接受范围之内。
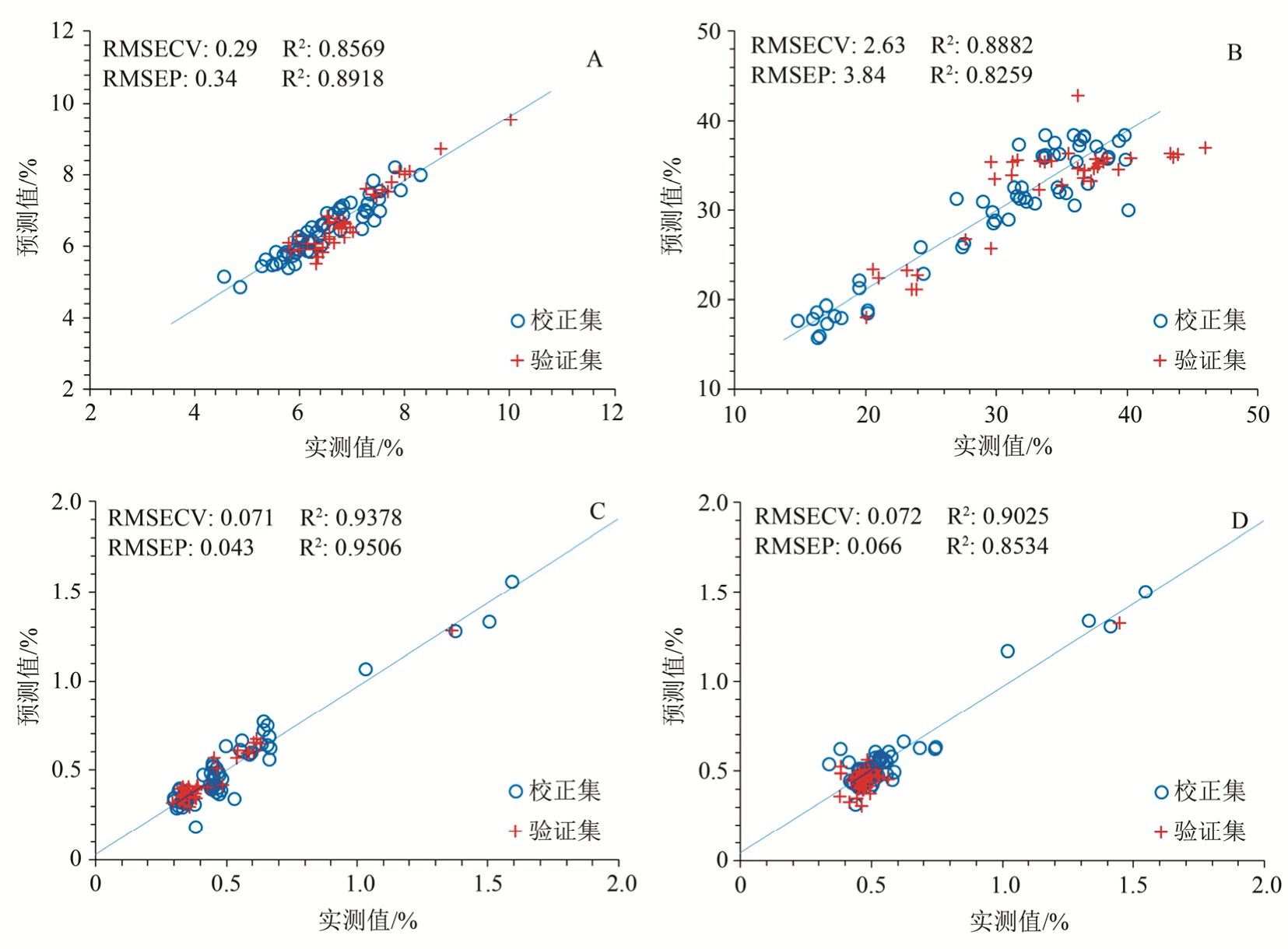
图4 各指标模型预测值与实际测定值相关性图
A-水分含量;B-蔗糖和麦芽糖总含量;C-人参皂苷Rg1和Re总含量;D-人参皂苷Rb1含量。
Fig. 4 Correlation graph of predicted value and measured value of each index model
A-wate content; B-total content of sucrose and maltose; C-total content of ginsenoside Rg1and Re; D-content of ginsenoside Rb1.
表5 各指标模型预测整体评价(n=38)
Tab. 5 Overall evaluation of each index model(n=38) %
3.4 近红外分析方法学考察
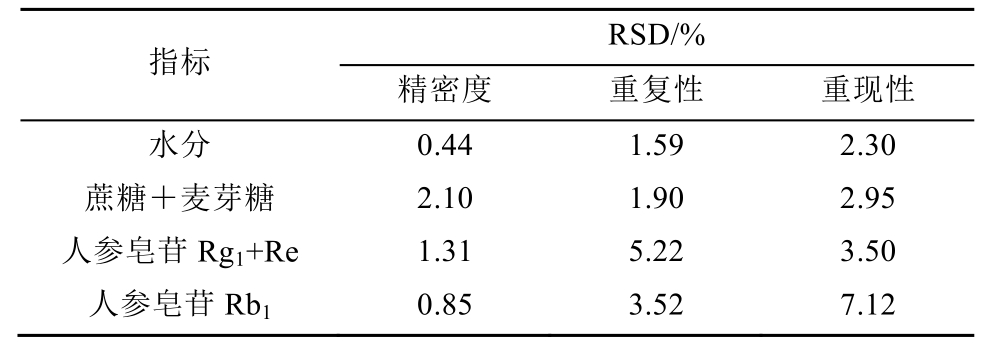
近红外分析方法学考察结果显示,精密度考察中各指标RSD%均<5%,表明所用近红外仪精密度较好;重复性考察中除人参皂苷Rg1和Re总含量的RSD值略>5%外,其他指标的RSD均在<5%,表明方法重复性较好。因模型建立和验证需要采集大批量样品,时间跨度较大,为保证分析前后仪器状态稳定以及样品指标成分在存放过程中化学性质稳定,对同一批样品每半个月进行一次测定,连续跟踪3个月,共测定6次,进行重现性考察,结果显示,除Rb1的RSD相对较高外,其他各指标的RSD均<5%,说明仪器状态较为稳定,方法重现性较好,并且样品在存放过程中相对稳定,可以满足分析要求,见表6。
表6 近红外分析方法学参数(n=6)
Tab. 6 Methodological parameters of NIR(n=6)
红参是多种中成药和其他相关产品的重要原料,只有保证原料的质量才能确保最终产品的安全可靠,因此原料的检测至关重要,通过检测可以有效地规避一些风险。医药企业传统原料的检测通常是按照药典等相关规定进行常规分析,由于分析方法通常较为繁琐、费时,因此只能从每批中抽取部分样品进行分析,可能会存在抽样检验代表性不足的问题,难以保证该批次所有样品的质量。通过本研究建立的红参近红外快速分析方法,可以对红参的关键质控指标水分、人参皂苷和糖类成分进行快速测定,计算结果较为准确。该方法检测简便、快速,可以提高现场抽样量,是对传统分析方法的有效补充,从而最大限度的保障红参原料的质量和后道工序的正常生产,避免因原料质量不合格而造成不必要的浪费。因本法针对的是红参粉末样品,因此除药材外,该方法还可用于红参饮片和相关中间体粉末的快速质量分析,具有广阔的应用前景。
另外,在研究中发现多份市售红参标识为无糖或不掺糖的样品,用近红外模型预测结果显示其糖成分超标,常规分析测定结果也确定其超标。红参糖成分超标,因其黏性较大会对生产设备(如打粉机)造成较为严重的损害,在生产中发现多次打粉机电机烧毁跟红参糖含量过高有关;同时糖含量过高也会直接影响最后产品的质量。因此,必须从药材源头对其进行严格控制。本研究建立的近红外模型可以快速地检测其糖含量是否超标,有助于快速判断该批红参是否掺糖,为国家有关部门加强对红参市场监管及质量控制提供参考。
由于近红外光谱检测灵敏度不高,因此在中药领域的应用仍然具有一定局限性,只适合样品中含量较高成分的分析,而不能用于痕量分析[24-25]。同时,本研究所用样本量也不是非常充足,所建立的模型还不够稳健,但是近红外模型具有延展性,后期可以收集更多样品参与建模,以此来提高模型稳定度和预测能力[26]。
[1] WANG G L, NIE L X, ZHANG J, et al. Identification of Radix Ginseng Rubra by near infrared spectroscopy [J]. Chin Tradit Herb Drugs(中草药), 2008, 39(3): 438-440.
[2] 中国药典. 一部[S]. 2015: 153-154.
[3] WANG P, ZHANG H, YANG H L, et al. Rapid determination of major bioactive isoflavonoid compounds during the extraction process of kudzu (Pueraria lobata) by near-infrared transmission spectroscopy [J]. Spectrochim Acta A, 2015(137):1403-1408.
[4] XUE J T, YANG Q W, JING Y, et al. Rapid determination of puerarin by near-infrared spectroscopy during percolation and concentration process of Puerariae Lobatae Radix [J].Pharmacogn Mag, 2016, 12(47): 188-192.
[5] YANG H L, LIU X S, QU H B, et al. Fast quality assessment of Radix Ginseng Rubra by near-infrared spectroscopy [J].Chin Tradit Herb Drugs(中草药), 2005, 36(6): 912-915.
[6] ZHANG H, HAN H Y, DUAN X Y, et al. Establishment of quantitative model for determining moisture content in Jiang Huang pills by near infrared spectroscopy [J]. Chin J Hosp Pharm(中国医院药学杂志), 2015, 18(18): 1668-1671.
[7] NIE L X, WANG G L, LIN R C. Development of near infrared spectroscopy for rapid quality assessment of red ginseng [J].Chem Res Chinese Universities, 2009, 25(5): 633-637.
[8] 中国药典. 四部[S]. 2015: 104.
[9] CHAN C O, CHU C C, MOK D K, et al. Analysis of berberine and total alkaloid content in cortex phellodendri by near infrared spectroscopy (NIRS) compared with highperformance liquid chromatography coupled with ultra-visible spectrometric detection [J]. Anal Chim Acta, 2007, 592(2):121-131.
[10] LI Y R, WANG Y H, YANG X W, et al. Analysis of saponins in black red ginseng by HPLC-MS/MS [J]. J Pharm Anal(药物分析杂志), 2013, 33(5): 812-817.
[11] LIU Y, LIU Z Y, CUI Y D, et al. Research on the correlations between the quality and the physiological status of the ginseng roots in different harvest time [J]. Ginseng Res(人参研究),2011, 23(3): 2-4.
[12] YANG X W, WANG H P, XU W, et al. Content analyses of ginsenosides in the roots and rhizomes of Panax ginseng from different regions [J]. J Pharm Anal(药物分析杂志), 2017,37(1): 30-36.
[13] WANG J J, CHEN N, HAN X, et al. The history of adulterants in ginseng and the survey of ginseng quality in current traditional Chinese medicinal material market [J]. Special Wild Econo Animal Plant Res(特产研究), 2016, 38(2): 58-62.
[14] LI W L, XING L H, CAI Y, et al. Classification and quantification analysis of Radix scutellariae from different origins with near infrared diffuse reflection spectroscopy [J].Vib Spectrosc, 2011, 55(1): 58-64.
[15] WANG D M, JI J M, GAO H Z. The effect of MSC spectral pretreatment regions on near infrared spectroscopy calibration results [J]. Spectrosc Spect Anal(光谱学与光谱分析), 2014,34(9): 2387-2390.
[16] CHEN C, LI W L, QU H B, et al. Online control of percolation of Fufang Kushen Injection using near infrared transflective spectroscopy [J]. Chin Tradit Herb Drugs(中草药), 2013,44(1): 47-51.
[17] NIU Z Y. The NIRS analysis of fish meal, concentrate supplement and MBM content inside [D]. Beijing: China Agricultural University, 2005.
[18] MUNRO K, MILLER T H, MARTINS C P B, et al. Artificial neural network modelling of pharmaceutical residue retention times in wastewater extracts using gradient liquid chromatography-high resolution mass spectrometry data [J]. J Chromatogr A, 2015(1396): 34-44.
[19] ZHOU Y, FU X P, YING Y B. Effect of humidity on detection of near-infrared spectra [J]. Spectrosc Spect Anal(光谱学与光谱分析), 2007, 27(11): 2197-2199.
[20] YUE D Y, WANG Q, AN J, et al. Preparation of compound beimu powder ultra-fine powder and contrastive study of its physical property and powder characterization with fine powder [J]. Chin J Exp Tradit Med Form(中国实验方剂学杂志), 2012, 18(17): 9-13.
[21] JIANG H Y, XIE L J, PENG Y S, et al. Study on the influence of temperature on near infrared spectra [J]. Spectrosc Spect Anal, 2008, 28(7): 1510-1513.
[22] WULFERT F, KOK W T, SMILDE A K. Influence of temperature on vibrational spectra and consequences for the predictive ability of multivariate models [J]. Anal Chem, 1998,70(9): 1761-1767.
[23] SHEN F, YING Y B, LI B B. Influence of temperature on near-infrared spectroscopic analysis models of alcohol and sugar content in Chinese rice wine [J]. Food Sci(食品科学),2014, 35(23): 25-28.
[24] LI L Q, ZHANG Z Z. Application of near-infrared spectroscopy in tea quality and safety [J]. J Food Safety Quality(食品安全质量检测学报), 2015, 6(5): 1530-1535.
[25] DU W F, WU Y, YUE X K, et al. Rapid determination of linderane and norisoboldine in Radix Linderae by near-infrared spectrometry [J]. Chin J New Drugs(中国新药杂志), 2017 24(6) :709-715.
[26] CAO W, LI W J, WANG P, et al. Analysis of the stability and adaptability of near infrared spectra qualitative analysis model[J]. Spectrosc Spect Anal(光谱学与光谱分析), 2014, 34(6):1506-1511.
Rapid Analysis of Multi-components of Ginseng Radix et Rhizoma Rubra Based on Near Infrared Spectroscopy
YING Xuhui, LI Jinghui, KONG Wanming, LI Dong, LIU Li*
(Institute of Chiatai Qingchunbao Pharmacetutical Co.,Ltd., Hangzhou 310023, China)
ABSTRACT:OBJECTIVE To establish a set of quantitative calibration models for rapid analysis of water, ginsenosides and carbohydrates in Ginseng Radix et Rhizoma Rubra (RGR) with near infrared spectroscopy (NIR), which is useful for the rapid evaluation of RGR quality. METHODS The quantitative calibration models of multi-components, including water,ginsenosides and carbohydrates, were developed using 62 batches of RGR with optimized spectral wavelength and pre-processing, as well as multivariate regression method; another 38 batches of samples were used for model validation and evaluation. RESULTS The quantitative models of water, total content of ginsenosides Rg1and Re, content of ginsenosides Rb1and total content of sucrose and maltose had good ability to predict, all relative deviations of predict results were <15%; the precision and reproducibility of the NIR rapid analysis method was also good. CONCLUSION It is a promising method for rapid analysis the key quality control indicators of RGR, the results are reliable, indicating it is an effective complement to traditional analytical methods; according to the prediction data, it can also effectively guide the subsequent process of production,avoiding the unnecessary waste caused by unqualified herbal medicines.
KEY WORDS:Ginseng Radix et Rhizoma Rubra; near infrared spectroscopy (NIR); rapid quality evaluation; analysis of doping carbohydrates
REFERENCES
中图分类号:R284.1;R917.101
文献标志码:B
文章编号:1007-7693(2017)10-1377-08
DOI:10.13748/j.cnki.issn1007-7693.2017.10.004
引用本文:应旭辉, 李静慧, 孔万明, 等. 基于近红外光谱技术的红参多指标成分快速分析[J]. 中国现代应用药学, 2017,34(10): 1377-1384.
红参(Ginseng Radix et Rhizoma Rubra)是五加科植物人参Panax ginsengC. A. Mey.经浸润、清洗、分选、蒸制、晾晒、烘干等工序加工而成的熟用品,具有大补元气、生津安神、益气摄血等功效[1]。目前红参质量控制主要是参照中国药典2015年版相关规定[2],对其水分、人参皂苷Rg1、Re及Rb1进行控制,其中水分采用干燥失重的方法进行检测,该方法比较费时;人参皂苷的检测采用HPLC,该方法样品前处理涉及索氏提取、超声提取、蒸干、复溶等步骤,整个分析过程比较繁琐,同时分析中使用的有机溶剂会对环境造成污染并且不利于人体的健康。另外,目前中国药典2015年版红参质量标准[2]没有对红参糖类成分进行质量控制,然而市场上红参掺糖(特别是蔗糖)的现象时有发生,严重影响了红参原料及相关产品的质量。对此,国家食品药品监督管理总局也加强了对红参糖类成分的监控力度,在前期发布了《红参药材及饮片中总还原糖检查项补充检验方法》的公告(2017年第20号),对总还原糖进行限量控制。传统糖类成分分析的方法主要为化学显色法、HPLC等,同样存在样品前处理复杂、分析比较费时等问题,显色法对反应终点判断的主观性也较大。
基金项目:国家中药标准化项目(ZYBZH-C-ZJ-60);浙江省中药现代化项目(浙经信医化[2012]773号)
作者简介:应旭辉,男,博士,工程师 Tel: (0571)58101888 E-mail: yxhtv@163.com*
通信作者:刘雳,男,博士,教授级高工 Tel:(0571)58101888 E-mail: boltliu@163.com
收稿日期:2017-05-22
(本文责编:蔡珊珊)