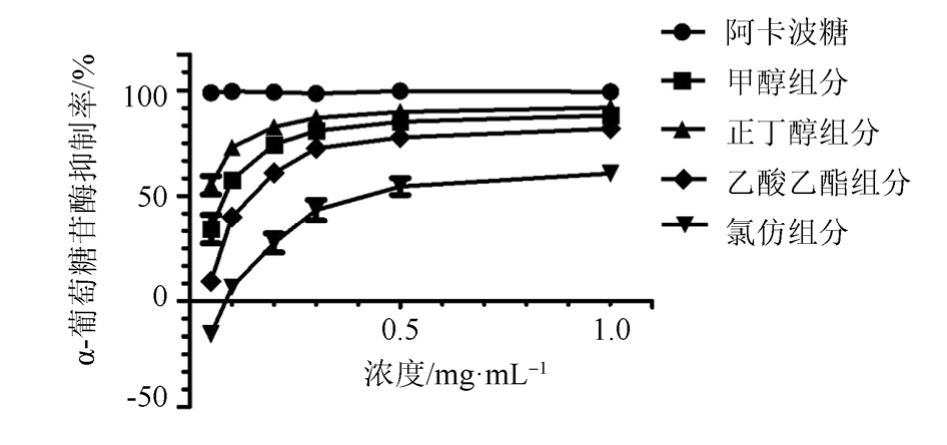
图1 衢枳壳不同极性组分α-葡萄糖苷酶抑制率
Fig. 1 α-glucosidase inhibitory rate of different polar components of Quzhiqiao
王笑笑1,王思为2,方月娟3,胡泽富2,钟松阳2,楼丽君2*
(1.衢州市食品药品检验研究院,浙江 衢州 324000;2.衢州市人民医院,浙江 衢州 324000;3.衢州市妇幼保健院,浙江 衢州 324000)
摘要:目的 研究衢枳壳不同极性组分体外降糖活性,并明确各组分中4种黄酮类化合物的含量。方法 采用系统溶剂法提取与分离衢枳壳中不同极性的黄酮组分,通过体外试验明确各组分对α-葡萄糖苷酶活性和HepG2细胞葡萄糖消耗的影响。采用Agilent Zorbax SB C18色谱柱(250 mm×4.6 mm,5 μm),以乙腈-0.02%磷酸水溶液(20︰80)为流动相,流速1.0 mL·min-1,检测波长280 nm,柱温35 ℃,外标法测定衢枳壳各组分中芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷的含量。结果 衢枳壳各组分均具有α-葡萄糖苷酶抑制作用,抑制强弱顺序为正丁醇组分[IC50:(0.033±0.010)mg·mL-1]>甲醇组分[IC50:(0.092±0.006)mg·mL-1]>乙酸乙酯组分[IC50:(0.170±0.014)mg·mL-1]>氯仿组分[IC50:(0.509±0.070)mg·mL-1];衢枳壳甲醇组分和正丁醇组分能够显著促进 HepG2细胞葡萄糖的消耗,差异具有统计学意义(P<0.05)。含量测定方法经方法学认证,各项参数均符合要求。经分析发现:衢枳壳各组分中均含有芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷等黄酮类化合物,且正丁醇组分中各黄酮成分含量最高。结论 衢枳壳各组分均具有α-葡萄糖苷酶抑制作用,且随着各组分中黄酮类化合物含量增高作用增强。同时,含有较高黄酮类组分含量的衢枳壳组分具有促进HepG2细胞葡萄糖消耗的作用,如甲醇、正丁醇和乙酸乙酯组分。
关键词:衢枳壳;黄酮类化合物;α-葡萄糖苷酶;HepG2;葡萄糖消耗
常山胡柚Citrus changshan-huyouY. B. Chang主产于浙江衢州地区,为我国特有的柑橘品种,是芸香科柑橘属植物柚[C. grandis(L.) Osbeck]与甜橙[C. sinensis(L.) Osbeck]的杂交品种[1]。2016年8月,常山胡柚的干燥未成熟果实以“衢枳壳”的名义被纳入2015年版《浙江省中药炮制规范》,正式成为一味中药。衢枳壳,味苦、辛、酸、微寒,归脾、胃经,具有理气宽中、行滞消胀、镇咳化痰、清热解毒、促进胃肠功能、抗氧化、降血脂、降血压等功效,其主要成分为挥发性成分和黄酮类化合物[2-4]。
有关临床和实验研究报道表明,适量食用常山胡柚的糖尿病患者血糖未升高,而其果肉中含有较多使血糖升高的葡萄糖和蔗糖,说明常山胡柚中可能存在调节血糖的物质,而这些降糖物质主要为黄酮类化合物[5-6]。相较于成熟胡柚果实,中药衢枳壳中糖分含量更低,黄酮类成分含量更高[7]。因此,作为药食同源的衢枳壳有望被开发成为具有较高安全性的降糖药物。目前,未见有关衢枳壳降糖作用的研究报道。本研究拟采用系统溶剂法分离出衢枳壳中不同极性组分,通过体外试验明确衢枳壳各组分对 α-葡萄糖苷酶活性以及hepG2细胞葡萄糖消耗的影响,并运用 HPLC进一步确定各组分的黄酮组成,为今后开发质量可控、成分清楚的降糖药物或保健品奠定实验基础。
MR-4100型酶标仪(美国Dynatech);Beckman coulter AU 5800全自动生化仪;Agilent 1260高效液相色谱仪,配制四元梯度泵、在线脱气机、自动进样器、二极管阵列检测器、柱温箱和Chemstation工作站;RV 10型旋转蒸发仪(德国IKA);XP 205型电子天平、ME1002E型电子天平(梅特勒托利多);HH-6数显恒温水浴锅(金坛市杰瑞尔电器有限公司);Scientz-10ND型普通多岐管冷冻干燥机(宁波新芝生物科技股份有限公司);SK5200HP型超波清洗器(上海科导超声仪器有限公司);TANKPE030型制水机(法国明澈TM-D)。
衢枳壳饮片由衢州南孔中药有限公司提供并由衢州市食品药品检验研究院主任中药师宋剑锋鉴定;α-葡萄糖苷酶(批号:L27M7Y15355)、新橙皮苷(批号:Z31J6L20067,含量:98%)、芸香柚皮苷(批号:P29M6R4,含量:98%)、柚皮苷(批号:K21F3C1,含量:98%)、对硝基苯基-α-D 吡喃葡萄糖苷/pNPG(批号:K04F8B28175)、阿卡波糖(批号:Y22S6Y17791)等均购自上海源叶生物科技有限公司;橙皮苷(中国食品药品检定研究院,批号:110721-201316,含量:95.3%);人肝癌细胞株HepG2(中国科学院上海细胞生物学研究所);MTT细胞增殖及细胞毒性检测试剂盒(博士德生物,批号:09I26C56);葡萄糖 GLU测定试剂盒(己糖激酶法)(上海科华生物工程股份有限公司,批号:20161112);磷酸、冰醋酸、甲醇、乙腈、乙酸乙酯、正丁醇、氯仿等,除乙腈为色谱纯外;其余均为分析纯。
2.1 衢枳壳不同极性组分的提取与分离
精密称取衢枳壳干燥粉末135 g,过二号筛,置于2 000 mL圆底烧瓶中,加甲醇1 350 mL,75 ℃加热回流2 h[8],趁热抽滤,分成4等份,旋转蒸干甲醇,取其中3份各加入纯化水100 mL,分别用正丁醇、乙酸乙酯和氯仿萃取 3次(均为100 mL),收集各萃取液,旋转蒸干溶剂;最后,上述残渣均用少量水溶解后,冷冻干燥、密封保存于干燥器中,得到甲醇组分、正丁醇组分、乙酸乙酯组分和氯仿组分,备用。
2.2 α-葡萄糖苷酶体外抑制试验[8]
取“2.1”项下制备的各组分加入少量二甲基亚砜(DMSO)溶解后,用pH 6.8的磷酸盐缓冲液分别稀释成浓度为 1,0.5,0.3,0.2,0.1,0.05 mg·mL-1作为供试样品。以阿卡波糖作为阳性对照。
空白组对照:在96孔板中依次加入10 μL酶液(1 U·mL-1)、160 μL 磷酸盐缓冲液(pH 6.8),在37 ℃反应 10 min,加入 30 μL pNPG(2 mmol·L-1,磷酸盐缓冲液配制),反应10 min后,测定405 nm处的吸光度(A酶活);空白组:在反应孔中依次加入170 μL磷酸盐缓冲液,在37 ℃反应10 min,加入30 μL pNPG,反应10 min后,测定405 nm处的吸光度(A酶空白);样品空白:在反应孔中依次加入10 μL 酶液、60 μL 磷酸盐缓冲液、100 μL 药物,在37 ℃反应10 min,加入30 μL磷酸盐缓冲液,反应10 min 后,测定405 nm处的吸光度(A样品空白);样品:在反应孔中依次加入10 μL酶液、60 μL磷酸盐缓冲液、100 μL药物,在37 ℃反应10 min,加入30 μL pNPG,反应10 min后,测定405 nm处的吸光度(A样品)。以上所有样品及空白反应均重复3次,取平均值作为实验数据。
供试样品对α-葡萄糖苷酶的抑制百分率=[(A酶活–A酶空白)–(A样品–A样品空白)]/(A酶活–A酶空白)×100%;并运用SPSS 17.0计算IC50值。
2.3 HepG2细胞增殖检测
人肝癌HepG2细胞株系,培养于含10%胎牛血清,1%双抗的DMEM培养液中,置于37 ℃ 5%CO2培养箱,生长密度达 80%后,用胰蛋白酶消化,1︰3传代培养。取“2.1”项下各组分用少量DMSO溶解后,用细胞培养基稀释至实验所需浓度,过微孔滤膜,备用。
HepG2细胞用PBS洗涤2次后,胰蛋白酶消化,收集细胞500 g,4 ℃离心3 min后弃去上清液,用完全培养基调整细胞悬液浓度,每孔加入100 μL,铺板使待测细胞调密度每孔 1 000~10 000,接种于96孔细胞培养板中,置于37 ℃ 5%CO2培养箱中培养。24 h后换含有衢枳壳不同组分的培养基,分 10,30,50,100,150,200 μg·mL-16个浓度,每个浓度设6孔。培养24 h后每孔加入10 μL MTT染色液,于培养箱中继续培养4 h。每孔加入100 μL Formanzan溶解液,置于摇床上振荡30 min,至结晶全部溶解,放入酶标仪(波长570 nm)测吸光值。同时设置调零孔(培养基、MTT染色液、Formanzan溶解液),对照孔(细胞、药物溶解介质、培养基、MTT染色液、Formanzan溶解液)。
2.4 HepG2细胞葡萄糖消耗检测
实验分HepG2细胞组和IR HepG2细胞组2部分进行。HepG2细胞组分为甲醇组分组、正丁醇组分组、乙酸乙酯组分组和氯仿组分组;IR HepG2细胞组分为模型组、罗格列酮组、甲醇组分组、正丁醇组分组、乙酸乙酯组分组和氯仿组分组。HepG2细胞组分别加入一定量的衢枳壳甲醇组分、正丁醇组分、乙酸乙酯组分和氯仿组分使含 100 μg·mL-1(下同);IR HepG2 细胞组分别加入胰岛素 10 μg·mL-1、胰岛素 10 μg·mL-1和罗格列酮 20 μg·mL-1、胰岛素 10 μg·mL-1和甲醇组分100 μg·mL-1、胰岛素 10 μg·mL-1和正丁醇组分100 μg·mL-1、胰岛素 10 μg·mL-1和乙酸乙酯组分100 μg·mL-1、胰岛素 10 μg·mL-1和氯仿组分100 μg·mL-1,同时设置对照组(正常培养基)以及空白组(含正常培养的无细胞孔),每组设3个复孔,于培养箱中培养 24 h。后取各组细胞上清液,于全自动生化仪测定细胞上清液中葡萄糖含量。葡萄糖消耗量=空白对照组葡萄糖含量–对照组或各给药组葡萄糖含量。
2.5 衢枳壳不同极性组分中黄酮类成分含量测定
2.5.1 色谱条件 Agilent Zorbax SB C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.02%磷酸水溶液(20︰80),流速为1.0 mL·min-1,进样体积25 μL,检测波长280 nm,柱温35 ℃[9]。
2.5.2 混合对照品溶液制备 精密称取柚皮苷和新橙皮苷对照品 24.33 mg和 19.57 mg,置同一20 mL量瓶中,加 20%乙腈溶解并定容,作为混合对照品 1;再精密称取芸香柚皮苷对照品8.65 mg和橙皮苷4.75 mg,置同一50 mL量瓶中,加 20%乙腈溶解并定容,摇匀,作为混合对照品溶液2。
2.5.3 供试品溶液制备 分别精密称取正丁醇、乙酸乙酯和甲醇提取物约20 mg,置100 mL量瓶中,氯仿提取物约100 mg置5 mL量瓶中,加20%乙腈溶解并定容,摇匀,即得。
2.5.4 方法学考察
①线性关系考察:精密量取混合对照品溶液1和2各3 mL,置10 mL量瓶中,加20%乙腈稀释至刻度,摇匀,作为L1溶液;精密移取L1溶液适量,分别再稀释10倍、50倍、250倍和832.5倍制成L2、L3、L4和L5溶液;最后精密吸取上述 L1~L5溶液各 25 μL,注入液相色谱仪,按“2.5.1”项下色谱条件进行试验,记录色谱峰。
②精密度和稳定性试验:精密吸取 L2溶液25 μL,按“2.5.1”项下色谱条件连续进样6次;并分别在0,4,8,12和16 h测其稳定性,记录色谱峰,计算RSD。
③回收率试验:精密称取甲醇组分0.105 31 g,置25 mL量瓶中,加20%乙腈溶解并稀释至刻度,摇匀,制成样品储备液。再精密移取样品储备液1 mL,置10 mL量瓶中,分别精密加入混合对照品溶液1和2各1 mL,加20%乙腈溶液定容,摇匀。按“2.5.1”项下色谱条件进行试验,记录色谱峰,计算加样回收率。
④重复性实验:精密量取样品储备液2 mL,置10 mL量瓶中,加20%乙腈定容,摇匀。平行制备 6份,按“2.5.1”项下色谱条件进行试验,记录色谱峰,计算RSD。
2.6 统计学分析
所有数据均用SPSS 17.0统计软件进行处理,数据以x±s表示,组间差异按方差分析进行检验,并用最小显著差法检验作两两比较,以P<0.05为差异具有统计学意义。
3.1 衢枳壳各组分对α-葡萄糖苷酶的抑制作用
衢枳壳各黄酮组分均具有抑制 α-葡萄糖苷酶活性的作用,且抑制活性随着药物浓度的升高而升高,抑制强弱顺序为正丁醇组分[IC50:(0.033±0.010)mg·mL-1]>甲醇组分[IC50:(0.092±0.006)mg·mL-1]>乙酸乙酯组分[IC50:(0.170±0.014)mg·mL-1]> 氯 仿 组 分 [IC50: (0.509±0.070)mg·mL-1]。结果见图 1。

图1 衢枳壳不同极性组分α-葡萄糖苷酶抑制率
Fig. 1 α-glucosidase inhibitory rate of different polar components of Quzhiqiao
3.2 衢枳壳各组分对HepG2细胞葡萄糖消耗的影响
MTT结果显示,不同浓度的衢枳壳组分对HepG2细胞增殖及抑制无明显影响,见表1;衢枳壳各组分具有促进 HepG2细胞葡萄糖消耗的作用,尤其正丁醇组分和甲醇组分明显。与对照组比较,正丁醇组分、甲醇组分和乙酸乙酯组分葡萄糖消耗具有统计学差异(P<0.05),结果见表2。
3.3 方法学考察结果
以各对照品进样量(μg)为横坐标,各对照品峰面积为纵坐标进行线性回归,4个化合物的线性回归方程见表3,线性关系良好(r>0.999)。由表4可知,芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷对照品在16 h内稳定性良好,仪器精密度良好,以及方法稳定性良好。
表1 衢枳壳各组分对HepG2细胞增殖的影响(n=6,x±s)
Tab. 1 The effects of various components of Quzhiqiao on the proliferation of HepG2 cells(n=6,x±s)
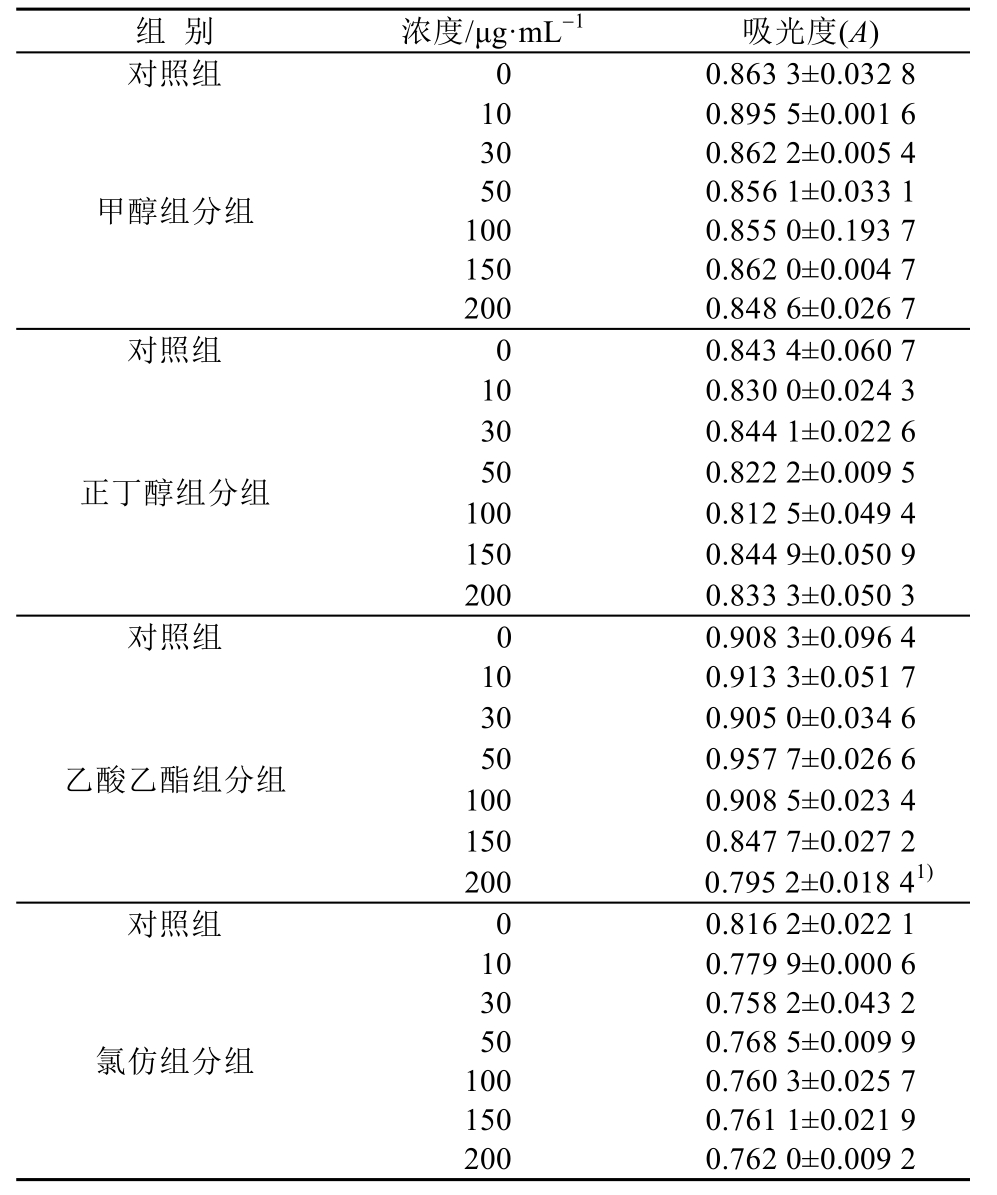
注:与对照组比较,1)P<0.05。
Note: Compared with control group,1)P<0.05.
表 2 衢枳壳各组分对 HepG2细胞葡萄糖消耗的影响(n=3,x±s)
Tab. 2 The effects of various components of Quzhiqiao on glucose consumption in HepG2 cells(n=3,x±s)
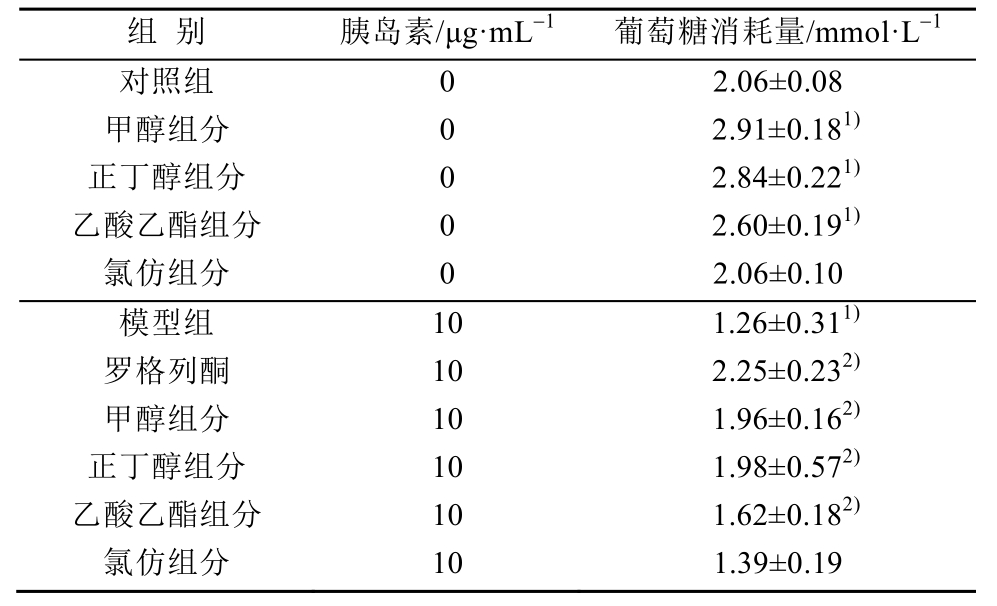
注:与对照组比较,1)P<0.05;与模型组比较,2)P<0.05。
Note: Compared with normal group,1)P<0.05; compared with model group,2)P<0.05.
表3 4个化合物的回归方程
Tab. 3 Calibration curves of the four compounds

表4 4种化合物的稳定性、精密度、重复性和准确性试验结果表
Tab. 4 Results of the stability, precision, repeatability and accuracy of the four compounds
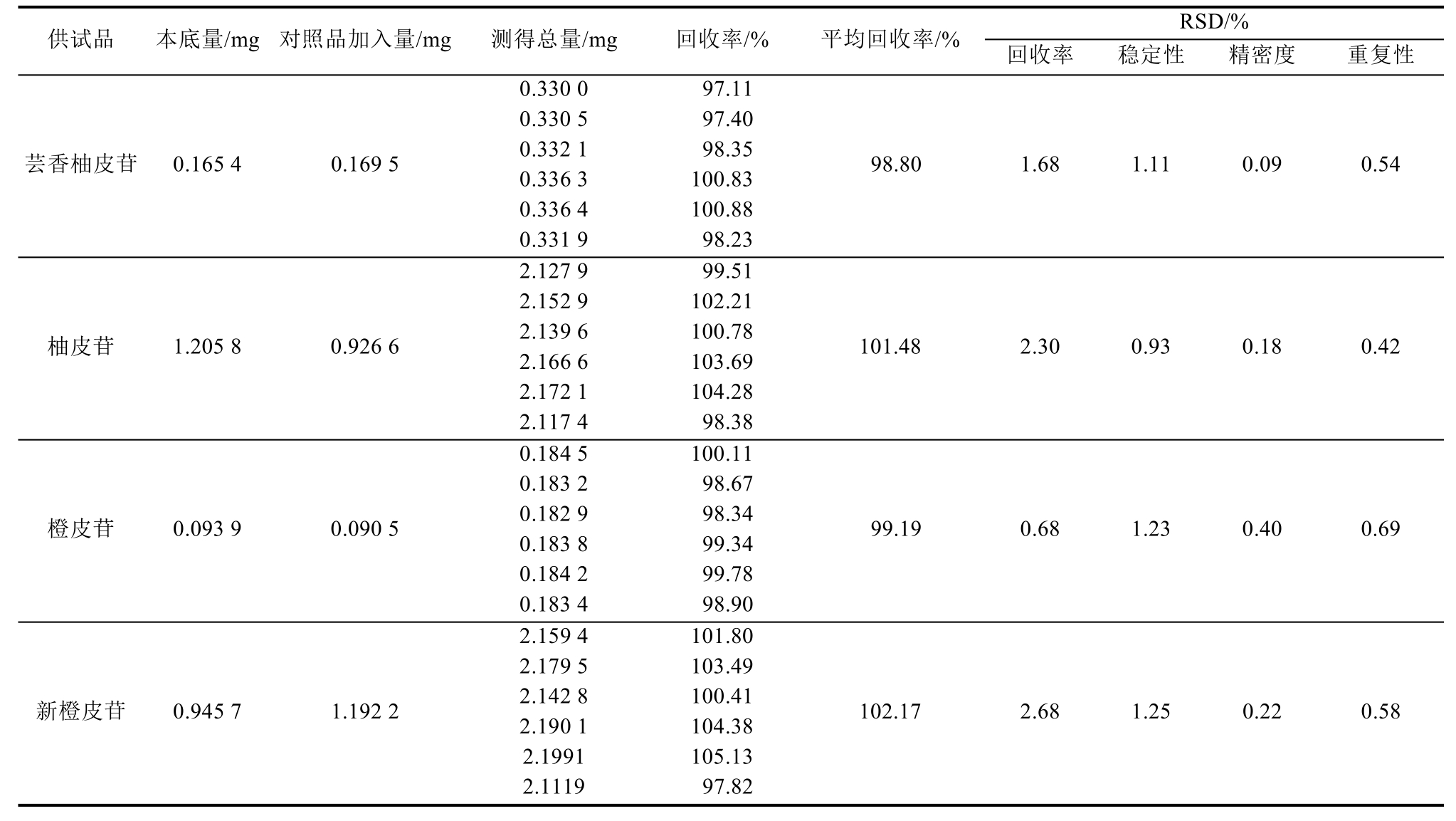
3.4 衢枳壳不同极性组分的得率和黄酮类化合物分析
衢枳壳不同极性组分的得率分别为:甲醇组分 21.35%,正丁醇组分 11.82%,乙酸乙酯组分3.09%和氯仿组分1.45%;同时,由表5可知,衢枳壳中的黄酮类组分以中等极性为主,主要由柚皮苷和新橙皮苷组成,芸香柚皮苷和橙皮苷次之;最后,各组分峰的分离度均>1.5,拖尾因子在1.09~1.21之间,具有较好的峰型和良好的分离度,见图2。
据文献报道,常山胡柚与中国药典2010年版收载的“枳壳”性状和成分均相似[9]。浙江大学赵雪梅教授对常山胡柚的化学成分进行了大量研究,发现常山胡柚中主要以挥发性和黄酮类化合物为主,其中黄酮类成分主要为柚皮苷、橙皮苷和新橙皮苷等[10-11]。笔者采用系统溶剂法分离了衢枳壳中不同极性组分,并通过 HPLC测定了衢枳壳各组分中黄酮类化合物的含量,结果表明衢枳壳中主要的黄酮类化合物为芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷。各组分中柚皮苷含量最高,其次为新橙皮苷,且正丁醇组分总黄酮含量最高。
表5 衢枳壳各组分黄酮化合物含量的比较(n=3)
Tab. 5 Comparison of flavonoids’ content in different components of Quzhiqiao(n=3) %
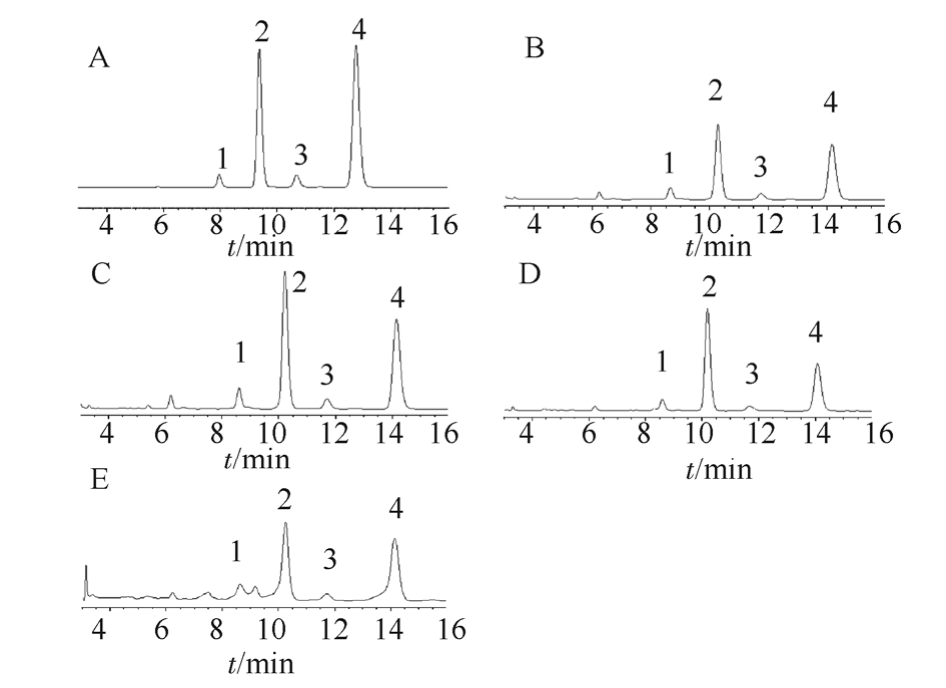
图2 对照品及衢枳壳各组分的HPLC色谱图
A-对照品;B-甲醇组分;C-正丁醇组分;D-乙酸乙酯组分;E-氯仿组分;1-芸香柚皮苷;2-柚皮苷;3-橙皮苷;4-新橙皮苷。
Fig. 2 The HPLC chromatogram of the reference substance and each components of Quzhiqiao
A-reference substance; B-Methanol component; C-Butanol component;D-Ethyl acetate component; E-Chloroform components; 1-Narirutin; 2-Naringin; 3-Hesperidin; 4-Neohesperidin.
近年来多项实验研究表明,常山胡柚具有抑制 α-葡萄糖苷酶活性的作用。何静[12]研究发现,胡柚具有平衡糖尿病小鼠血糖的作用,其机制可能与抑制 α-葡萄糖苷酶有关。王艳丽等[13]和张俊等[5]研究常山胡柚果肉提取物能够拮抗3T3-L1脂肪细胞对葡萄糖的摄取,其正丁醇组分对 α-葡萄糖苷酶有一定的抑制作用,抑制率与浓度呈正相关,抑制类型为竞争性抑制,这说明常山胡柚中有些极性较强的组分具有较好的降血糖功效。此外一些研究发现,胡柚中多种黄酮成分也具有降血糖、改善胰岛素抵抗的作用。柚皮苷能够调节血糖,减轻糖尿病酮症酸中毒的作用;同时其还具有较强的自由基清除能力,能够调节肝脏氧化应激和炎症反应,并通过调控PPAR-γ信号通路改善 2型糖尿病大鼠胰岛素抵抗[14-15]。殷章红等[16]和Agrawal等[17]的研究显示,橙皮苷能够调控JNK信号通路以及PPAR-γ信号通路改善2型糖尿病胰岛素抵抗。阎优优等[18]研究表明,新橙皮苷也具有调节糖脂代谢的作用,其机制可能与其调节AMPK、PPAR-α信号通路有关。本研究发现,衢枳壳甲醇组分、正丁醇组分、乙酸乙酯组分和氯仿组分均具有 α-葡萄糖苷酶抑制作用,同时衢枳壳甲醇、正丁醇和乙酸乙酯组分具有促进 HepG2细胞葡萄糖消耗的作用,且随着各组分中黄酮类化合物含量增高作用增强。
总之,衢枳壳中黄酮类化合物主要由芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷组成,且其黄酮组分具有抑制 α-葡萄糖苷酶活性,调节肝细胞糖代谢的作用。本课题组将在今后的研究工作中,进一步明确衢枳壳黄酮组分的降糖作用及机制,以期将其开发成为安全性高、疗效确切的降糖药物或保健品。
[1] ZHAO X M, YE X Q, ZHU D Y. Chemical constituents in peels of Citrus changshan-huyou (Ⅲ) [J]. Chin Tradit Herb Drugs(中草药), 2009, 40(1): 6-8.
[2] WEI Z, HE Y Q. Flora of Zhejiang [M]. Hangzhou: Zhejiang Science and Technology Press, 1993: 438.
[3] BEI Y Z, YE X Y. Characteristics and cultivation technology of Changshan Huyou [M]. Beijing: Chinese Science and Technology Press, 2003: 2-10.
[4] 赵燕宜, 高雨濛. 浙江省炮制规范 2015年版[M]. 第 1版.北京: 中国医药科技出版社, 2016.
[5] ZHANG J, HE J, ZHOU J Y, et al. α-glucosidase inhibitory activity of compounds from citrus Changshan-huyou [J]. J Chin Inst Food Sci Tech(中国食品学报), 2013, 13(2): 79-82.
[6] ZHAO X M, YE X Q, ZHU D Y, et al. Isolation and identification of chemical constituents from peels ofCitrus changshan-huyouY.B.Chang [J]. J Peking Univ (Health Sci)(北京大学学报: 医学版), 2009, 41(5): 575-577.
[7] SONG J F, FENG J Q, HU J H, et al. Study on the dynamic changes of three contents in citrus Changshan huyou fruit in different growth periods [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2014, 31(12): 1474-1478.
[8] LI F M, WANG Y, WEI M. Study onin vitroAntioxidant and α-glucosidase inhibitory activities of ethanol extract fromRosae roxburghiileaves [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(6): 685-688.
[9] GUO Z X, LI W T, LI Z K. Determination of naringin and neohesperidin inAurantii Fructusfrom different habitats [J].Chin Tradit Herb Drugs(中草药), 2012, 43(7): 1347-1348.
[10] ZHAO X M, YE X Q, ZHU D Y, et al. A novel compound isolated from the peels ofCitrus changshan-huyouY. B. Chan[J]. Acta Pharm Sin(药学学报), 2008, 43(12): 1208-1210.
[11] ZHAO X M, YE X Q, XI Y F, et al. Study on the extraction of flavonoids and antioxidation in huyou peels [J]. J Fruit Sci(果树学报), 2003, 20(4): 261-265.
[12] HE J. Preliminary study on balancing blood sugar effect ofCitrus changshan-huyouon diabetic ICR mice and its mechanism [D]. Nanjing: Nanjing Agricultural University,2011.
[13] WANG Y L, ZHANG J, ZHU W J, et al. Study on the Hypoglycemic effects of huyou fruits and the distribution of hypoglycemic components [J]. Acta Nutri Sin(营养学报),2015, 37(2): 173-177.
[14] QI Z, XU Y, LIANG Z, et al. Naringin ameliorates cognitive deficits via oxidative stress, proinflammatory factors and the PPARγ signaling pathway in a type 2 diabetic rat model [J].Mol Med Rep, 2015, 12(5): 7093-7101.
[15] MURUNGA A N, MIRUKA D O, DRIVER C, et al.Grapefruit derived flavonoid naringin improves ketoacidosis and lipid peroxidation in type 1 diabetes rat model [J]. PLoS One, 2016, 11(4): e0153241.
[16] YIN Z H, LUO P C, WANG C Y. Hesperidin reduced insulin resistance index of diabetes rat by inhibiting JNK signaling pathway [J]. J Changchun Univ Tradit Chin Med(长春中医药大学学报), 2015, 31(3): 460-462.
[17] AGRAWAL Y O, SHARMA P K, SHRIVASTAVA B, et al.Hesperidin produces cardioprotective activity via PPAR-γ pathway in ischemic heart disease model in diabetic rats [J].PLoS One, 2014, 9(11): e111212.
[18] YAN Y Y. Effects and mechanisms of neohesperidin on glucose and lipid metabolismin vitroandin vivo[D]. Zhejiang:Zhejiang University, 2014.
Study on the Hypoglycemic Activity of Different Components of Quzhiqiao in Vitro and Analysis of Four Flavonoids
WANG Xiaoxiao1, WANG Siwei2, FANG Yuejuan3, HU Zefu2, ZHONG Songyang2, LOU Lijun2*
(1.Quzhou Institute for Food and Drug Control, Quzhou 324000, China; 2.Quzhou People’s Hospital, Quzhou 324000, China; 3.Women and Children Hospital of Quzhou, Quzhou 324000, China)
ABSTRACT:OBJIECTIVE To study the hypoglycemic activity of different components of Quzhiqiaoin vitroand clarify the content of 4 flavonoid compounds in each component. METHODS The flavonoids with different polarities were extracted and separated by system solvent method, their α-glucosidase inhibitory activity were demonstrated by inhibitory test of α-glucosidasein vitro, and their effects on the glucose consumption of HepG2 cells were also investigated. An HPLC method was established with an Agilent Zorbax SB C18column (250 mm×4.6 mm, 5 μm), acetonitrile-0.02% phosphoric acid solution (20︰80) as the mobile phase, the flow rate was 1.0 mL·min-1, the detection wavelength was 280 nm, and the column temperature was 35 . ℃Finally, the content of rutinine, naringin, hesperidin and neohesperidin in different components of Quzhiqiao were determined by external standard method. RESULTS The components of Quzhiqao had α-glucosidase inhibitory effects, their order of inhibitory activity was:n-butanol component[IC50: (0.033±0.010) mg·mL-1]>methanol component[IC50: (0.092±0.006)mg·mL-1]>ethyl acetate component[IC50: (0.170±0.014)mg·mL-1]>chloroform components[IC50: (0.509±0.070)mg·mL-1]. The methanol component andn-butanol component of Quzhiqiao could significantly promote the consumption of glucose in HepG2 cells and the differences were statistically significant (P<0.05). Through methodological certification, the parameters of content determination method were all in line with the requirements. And the experiment found that each component of Quzhiqiao was all composed of rutininenaringin, naringin, hesperidin and new hesperidin, and then-butanol component had the highest content of flavonoids.CONCLUSION Each component of Quzhiqiao all have good α-glucosidase inhibitory activity, and the inhibitory effect is enhanced with the increase of the concentration of flavonoids in the components. Simultaneously, the higher content of flavonoids such as methanol component,n-butanol component and the ethyl acetate component all have the effect of promotingthe glucose consumption of HepG2 cells.
KEY WORDS:Quzhiqiao; flavonoids; α-glucosidase; HepG2; glucose consumption
REFERENCES
中图分类号:R284.1;R285.5
文献标志码:B
文章编号:1007-7693(2017)10-1418-06
DOI:10.13748/j.cnki.issn1007-7693.2017.10.012
引用本文:王笑笑, 王思为, 方月娟, 等. 衢枳壳不同组分体外降糖活性研究及 4种黄酮组分含量分析[J]. 中国现代应用药学, 2017, 34(10): 1418-1423.
基金项目:衢州市科技计划项目(2016J016);衢州市科技局指导性项目(2016114);浙江省中医药科技计划项目(2018ZB134)
作者简介:王笑笑,女,副主任药师 Tel: (0570)8358017 E-mail: 123143807@qq.com*
通信作者:楼丽君,女,主任药师 Tel:(0570)3055197 E-mail: 405480069@qq.com
收稿日期:2017-04-07
(本文责编:李艳芳)