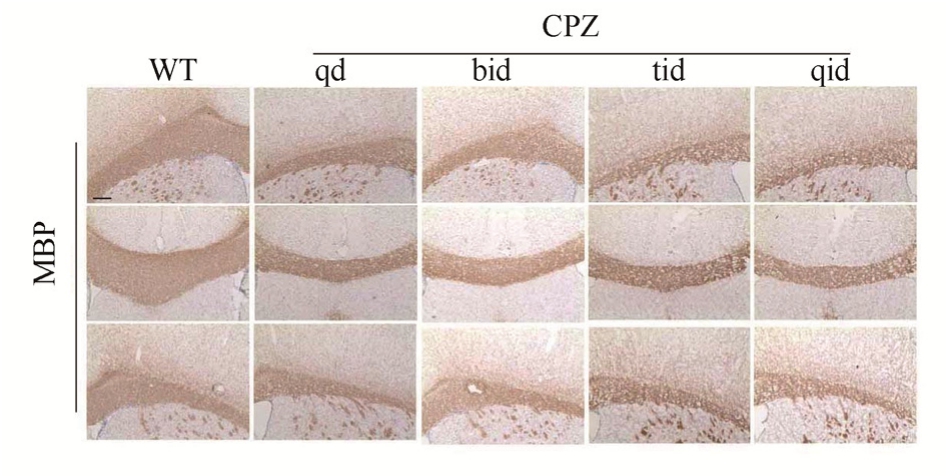
图 1 小鼠灌胃 2周后 MBP染色情况(横切面,标尺=25 μm)
Fig. 1 Expression of MBP in cerebral white matter after 2 weeks of intragastric administration (transverse section,scale=25 μm)
谭笔琴1,翁勤洁2,王飞1,王佳颖2,赵梦婷2,郑佳焕2,严伟1*
(1.南京医科大学附属杭州医院(杭州市第一人民医院)药学部,杭州 310006;2.浙江大学药学院药物毒理和生化药学研究所,杭州 310058)
摘要:目的 改进双环己铜草酰二腙(cuprizone,CPZ)诱导脱髓鞘小鼠模型的制备方法,为治疗脱髓鞘疾病提供更精准快速的动物模型。方法 取60只18~20 g的C57BL/6小鼠,分成空白对照组,CPZ灌胃组(共4组,300 mg·kg-1,qd,bid,tid,qid),CPZ饲喂组(即传统模型组),每组10只。空白对照组及CPZ灌胃组给予正常饲料,CPZ饲喂组给予0.2% CPZ混合鼠饲料连续饲喂6周构建小鼠脱髓鞘模型,通过免疫组化和髓鞘染色技术LFB检测髓鞘脱失情况,并比较CPZ灌胃模型和传统模型诱导小鼠急性髓鞘脱失的差异。结果 作用 3周后,4组 CPZ灌胃组的小鼠脑胼胝体区髓鞘碱性蛋白MBP染色与对照组相比均明显减少,而传统模型中小鼠脑胼胝体区MBP在第3周并未显著改变,在第6周明显减少。LFB染色结果表明CPZ灌胃3周后小鼠脑胼胝体区染色显著减少。结论 改进后的模型(小鼠CPZ灌胃模型)小鼠在第3周即能出现脱髓鞘现象,能有效缩短时间,具有显著优越性,且CPZ剂量可控,保证模型的精准性。
关键词:双环己铜草酰二腙;脱髓鞘;灌胃
中枢神经系统髓鞘来源于少突胶质细胞,包裹在神经元轴突表面形成多层膜结构,具有保证神经信息高速传导,绝缘以及提供营养等作用[1-3]。少突胶质细胞受损会影响髓鞘的正常功能,导致中枢神经系统脱髓鞘疾病,如最常见的多发性硬化症[4-5]。全世界多发性硬化症患者人数达到 250万,并呈现逐年上升的趋势,脱髓鞘是其主要的病因[6-7]。目前对脱髓鞘分子机制的研究仍不够深入,构建脱髓鞘动物模型研究脱髓鞘分子机制对治疗脱髓鞘疾病有重要意义。
双环己铜草酰二腙(cuprizone,CPZ)是一种铜离子螯合剂,可特异性诱导少突胶质细胞凋亡,长期喂食小鼠会诱导小鼠发生脱髓鞘现象,由CPZ诱导的脱髓鞘模型是经典的脱髓鞘动物模型之一,模拟非炎性介导的大脑白质中髓鞘损伤[8]。该模型采用含0.2% CPZ的鼠粮饲喂小鼠6周左右建立损伤模型,模型简单稳定,但建模耗时较长。因此本研究采用灌胃小鼠CPZ 3周的方法建立小鼠脱髓鞘模型,该方法也能引起同传统模型一致的小鼠脱髓鞘现象,但明显缩短建模时间,且CPZ药物剂量可控,模型稳定,有利于进行后续实验研究。
1.1 材料
1.1.1 动物 C57BL/6小鼠,60只,♂,18~20 g,购自上海史莱克实验动物有限公司,实验动物合格证编号:2008001652446,常规饲养,20~25 ℃,相对湿度60%~70%,根据实验要求饲喂饲料,期间小鼠饮水摄取自由。
1.1.2 试剂 免疫组化试剂盒(北京中杉金桥生物有限公司,PV-6002,批号:K166616G);Solvent blue 38(Sigma,S3382-25G,批号:MKBQ4800V);髓磷脂碱性蛋白(myelin basic protein,MBP,Covance,SMI-94R,批号:ab62631);CPZ混合饲料(北京科澳协力饲料有限公司,批号:15043113,配方,SPF鼠生长繁殖饲料中添加0.2%CPZ)。
1.2 方法
1.2.1 CPZ配制方法 20 g左右小鼠每日所需饲料约 3 g,根据传统模型中小鼠饲喂量,即 0.2%CPZ饲料经换算可知20 g左右小鼠每日需6 mg CPZ。因此给药剂量为 300 mg·kg-1,采用 0.5%CMCNa配置而成。
1.2.2 分组 C57BL/6小鼠60只,随机数字表法分为6组,即对照组(WT,10只):正常饲料饲喂;CPZ饲喂组(10只):用含0.2%的CPZ饲料饲喂;CPZ灌胃组A(10只):300 mg·kg-1CPZ灌胃3周,每天 1次(qd);CPZ灌胃组 B(10只):300 mg·kg-1CPZ灌胃3周,每天2次(bid)。CPZ灌胃组C(10只):300 mg·kg-1CPZ灌胃 3周,每天 3次(tid)。CPZ灌胃组D(10只):300 mg·kg-1CPZ灌胃3周,每天4次(qid)。
1.2.3 组织准备 在规定时间将所需动物灌流4% PFA,取脑组织,4% PFA 4 ℃固定 1 h,1×PBS洗 5次(每次 30 min),25%蔗糖脱水过夜后进行OCT包埋,连续冰冻切片,片厚12 μm,用于免疫组化染色和髓鞘染色。
1.2.4 免疫组化染色 对照组和实验组小鼠的切片在1×抗原修复液中经微波修复5 min,共3次;0.3% H2O2室温孵育10 min后1×PBS洗3次,羊血清封闭,一抗过夜,二抗孵育 30 min,显色剂显色,自来水终止后复染,封片即可。
1.2.5 罗克沙尔坚牢蓝(Luxol Fast Blue,LFB)染色 冰冻切片在70%,80%,90%,95%的乙醇中逐步脱水,0.1% LFB,56 ℃水浴过夜(16~25 h以上),冷却,95%乙醇冲洗,超纯水冲洗,0.05%碳酸锂分化,双蒸水冲洗,重复 7~8次,直至白质与灰质分界明显,0.1%焦油紫复染30 s(提前水浴至 56 ℃,目的旨在染核与尼氏小体),双蒸水冲洗,100%乙醇,5 min,二甲苯,5 min,最后树胶封片即可。
2.1 小鼠灌胃CPZ 2周MBP染色减少
CPZ灌胃2周后,取WT组及CPZ灌胃4组的小鼠脑组织切片,采用免疫组化进行MBP染色。结果表明,WT组中小鼠胼胝体及白质区MBP表达丰富,而在 CPZ灌胃组中,小鼠脑胼胝体区MBP染色减少,以每天灌胃3次和4次的组别更为明显,说明小鼠灌胃CPZ 2周开始出现脱髓鞘现象。结果见图1。

图 1 小鼠灌胃 2周后 MBP染色情况(横切面,标尺=25 μm)
Fig. 1 Expression of MBP in cerebral white matter after 2 weeks of intragastric administration (transverse section,scale=25 μm)
2.2 小鼠灌胃CPZ 3周MBP染色明显减少
CPZ作用第 3周时同样进行小鼠脑组织切片MBP染色,CPZ小鼠脑胼胝体相较于WT组,MBP染色明显减少,其中每天灌胃3次和4次的组别更为明显,说明小鼠灌胃CPZ 3周后出现了明显的脱髓鞘现象。结果见图2~3。
为了进一步明确灌胃小鼠 3周出现的脱髓鞘现象,笔者对每天灌胃3次和4次的组别进行针对性重复,结果与之前一致,灌胃CPZ 3周的小鼠脑胼胝体区出现了明显的脱髓鞘现象。综上所述,改进后的模型方法能够引起脱髓鞘现象。结果见图4。
2.3 传统模型小鼠第6周MBP染色明显减少
对传统模型(正常饲喂0.2% CPZ饲料)的小鼠脑组织进行免疫组化染色,结果显示,小鼠脑胼胝体MBP染色在第3周时与WT组相比变化不大,第6周时明显减少,见图5,表明饲喂0.2% CPZ饲料小鼠在第 6周时出现了明显脱髓鞘现象。并对各组的成模率进行分析统计,CPZ饲喂,CPZ灌胃组qd,CPZ灌胃组bid,CPZ灌胃组tid,CPZ灌胃组 qid的成模率分别为(91.67±1.87)%,(88.33±2.78)%,(86.67±3.37)%,(93.33±2.67)%,(91.00±2.00)%。CPZ灌胃各组与传统模型相比,成模率相当。
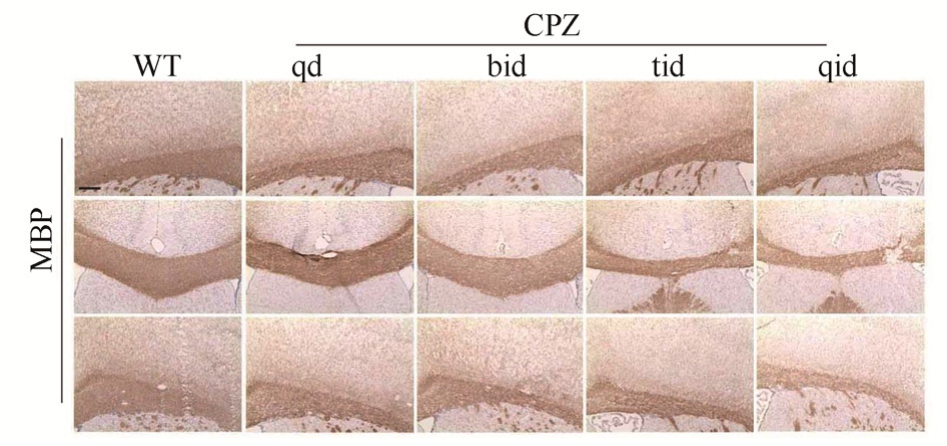
图 2 小鼠灌胃 3周后 MBP染色的变化(横切面,标尺=25 μm)
Fig. 2 Changes in MBP staining after 3 weeks of intragastric administration (transverse section, scale=25 μm)
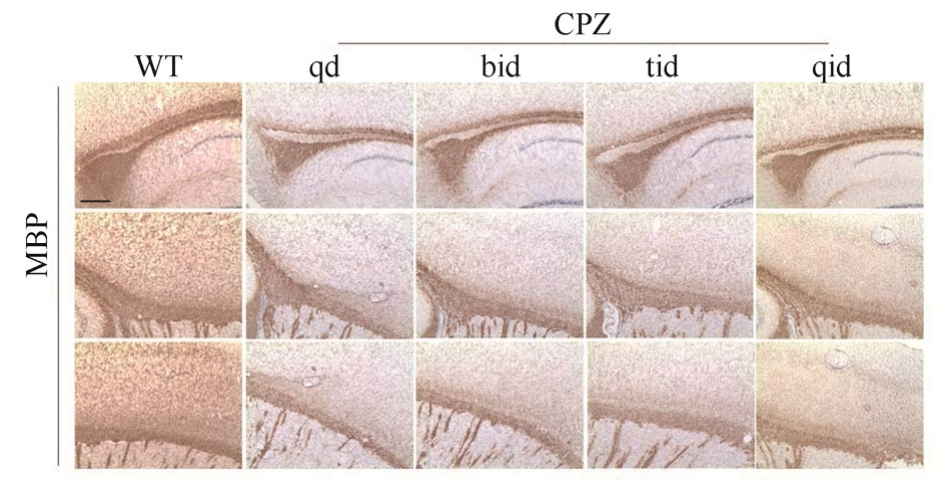
图 3 小鼠灌胃 3周后 MBP染色的变化(纵切面,标尺=25 μm)
Fig. 3 Changes in MBP staining after 3 weeks of intragastric administration (longitudinal section, scale=25 μm)
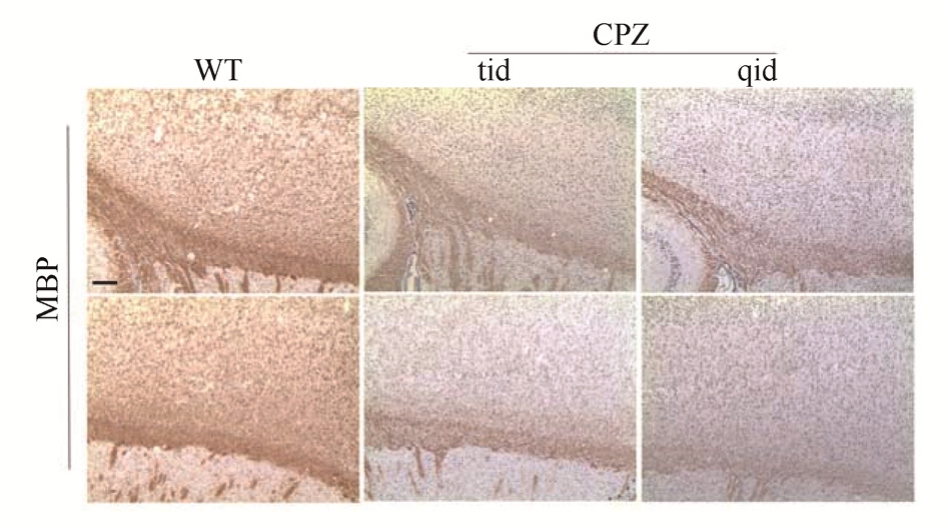
图 4 小鼠灌胃 3周后 MBP染色的变化(纵切面,标尺=25 μm)
Fig. 4 Changes in MBP staining after 3 weeks of intragastric administration (longitudinal section, scale=25 μm)
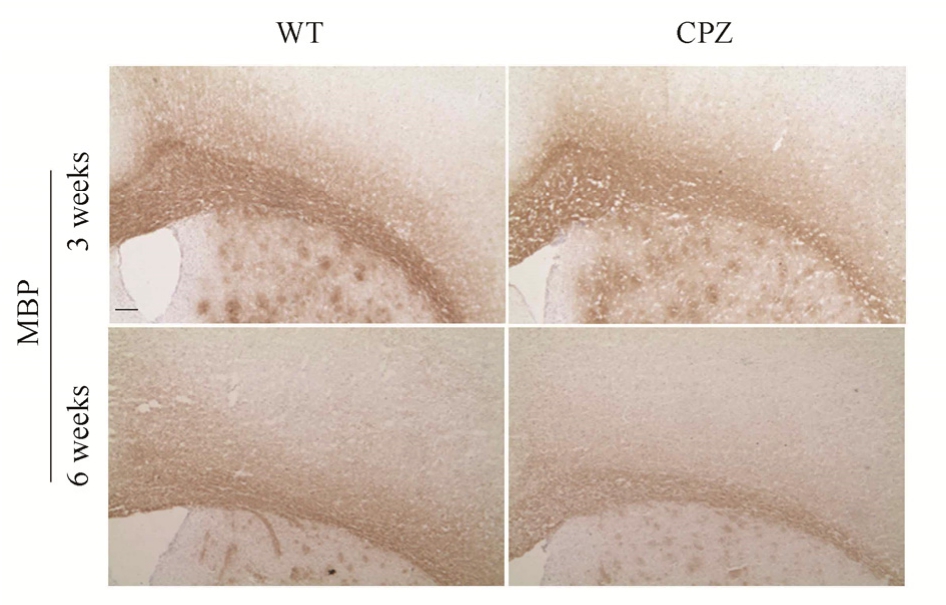
图5 小鼠饲喂铜腙6周后MBP染色的变化(横切面,标尺=25 μm)
Fig. 5 Changes of MBP staining in mice after feeding copper hydrazone for 6 weeks (transverse section,scale=25 μm)
2.4 CPZ灌胃小鼠3周出现明显脱髓鞘现象
选择 300 mg·kg-1·d-1铜腙灌胃 3周,每天 3次的小鼠进行LFB染色结果确认,结果显示相对于WT组,CPZ灌胃组小鼠胼胝体区染色明显减少,说明CPZ灌胃小鼠3周即可出现明显的脱髓鞘现象,结果见图6。
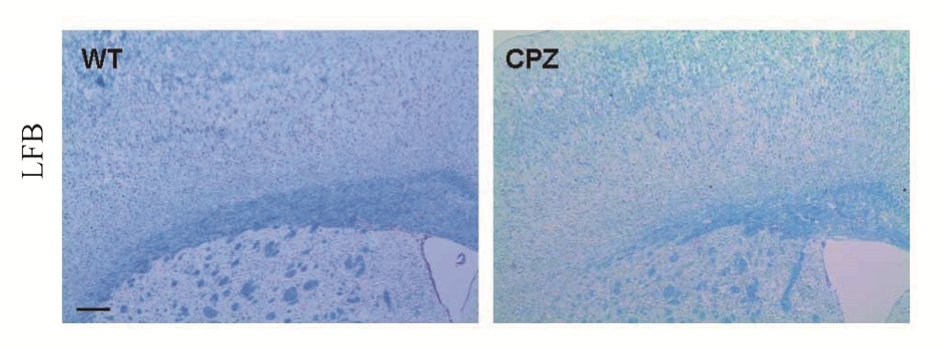
图 6 小鼠灌胃 3周后 LFB染色的变化(横切面,标尺=25 μm)
Fig. 6 changes in LFB staining after 3 weeks of intragastric administration (transverse section, scale=25 μm)
中枢神经系统脱髓鞘疾病是一种以中枢神经系统髓鞘脱失和炎症为主要表现的疾病[9-10],多发性硬化症(multiple sclerosis,MS)是其中的典型代表。目前尚无有效的治疗方法,由于组织取材的局限性,建立脱髓鞘疾病动物模型模拟疾病病理改变对于脱髓鞘疾病的治疗非常必要。
常用的MS动物模型主要分为2种,实验性自身免疫性脑脊髓炎(EAE)模型和 CPZ模型。EAE模型通过一些髓鞘成分如MBP免疫动物,使其产生炎性脱髓鞘,主要用于免疫相关性的MS的发病机制的研究。CPZ模型是毒素诱导的脱髓鞘模型[10],该模型所诱导的脱髓鞘主要集中于脑胼胝体和皮层,作用于少突胶质细胞,而对星形胶质细胞和神经元影响较小。由于其诱导的脱髓鞘部位确定,应用广泛,包括研究局部脱髓鞘,髓鞘再生的机制以及抑制脱髓鞘和促进髓鞘再生的药物治疗等。文献报道[11-13],大鼠、豚鼠以及小鼠均可用于建立CPZ诱导脱髓鞘模型,其中以小鼠模型最为常见和稳定,多采用C57BL/6小鼠构建[14]。传统模型采用含0.2% CPZ的鼠粮饲喂小鼠6周左右建立,制备周期比较长,严重制约其应用。此外,通过饲料中添加0.2% CPZ饲喂小鼠,CPZ不能定量,诱导的小鼠模型损伤程度有差异。因此,本研究从其制备方法入手,采用灌胃CPZ的方式诱导小鼠脱髓鞘,结果表明灌胃 3周即能诱导明显脱髓鞘现象,有效缩短实验周期,且CPZ剂量可控,值得推广。
[1] BERCURY K K, MACKLIN W B. Dynamics and mechanisms of CNS myelination [J]. Dev Cell, 2015, 32(4):447-458.
[2] YANG M L, SHIN J, KEARNS C A, et al. CNS myelination requires cytoplasmic dynein function [J]. Dev Dyn, 2015,244(2): 134-145.
[3] O'ROURKE M, GASPERINI R, YOUNG K M. Adult myelination: wrapping up neuronal plasticity [J]. Neural Regen Res, 2014, 9(13): 1261-1264.
[4] KETELSLEGERS I A, VAN PELT D E, BRYDE S, et al.Anti-MOG antibodies plead against MS diagnosis in an Acquired Demyelinating Syndromes cohort [J]. Mult Scler,2015, 21(12): 1513-1520.
[5] ANASTASIADOU S, LIEBENEHM S, SINSKE D, et al.Neuronal expression of the transcription factor serum response factor modulates myelination in a mouse multiple sclerosis model [J]. Glia, 2015, 63(6): 958-976.
[6] WANG Y, SUN P, WANG Q, et al. Differentiation and quantification of inflammation, demyelination and axon injury or loss in multiple sclerosis [J]. Brain, 2015, 138(Pt5):1223-1238.
[7] KISHK N A, ABOKRYSHA N T, RASHED L, et al.Diagnostic value of aquaporin 4 antibody in assessing idiopathic inflammatory demyelinating central nervous system diseases in Egyptian patients [J]. J Clin Neurosci, 2015, 22(4):670-675.
[8] SLOWIK A, SCHMIDT T, BEYER C, et al. The sphingosine 1-phosphate receptor agonist FTY720 is neuroprotective after cuprizone-induced CNS demyelination [J]. Br J Pharmacol,2015, 172(1): 80-92.
[9] GOTTLE P, SABO J K, HEINEN A, et al. Oligodendroglial maturation is dependent on intracellular protein shuttling [J]. J Neurosci, 2015, 35(3): 906-919.
[10] JIANG P, LIN C Q, YUAN C X, et al. General study on the effect of all-trans-retinoic acid on the nervous system of mice [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2016,33(10): 1260-1262.
[11] KANG Z Z, LIU L P, SPANGLER R, et al. IL-17-induced act1-mediated signaling is critical for cuprizone-induced demyelination [J]. J Neurosci, 2012, 32(24): 8284-8292.
[12] CLARNER T, JANSSEN K, NELLESSEN L, et al. CXCL10 triggers early microglial activation in the cuprizone model [J].J Immunol, 2015, 194(7): 3400-3413.
[13] PRAET J, GUGLIELMETTI C, BERNEMAN Z, et al.Cellular and molecular neuropathology of the cuprizone mouse model: clinical relevance for multiple sclerosis [J]. Neurosci Biobehav Rev, 2014(47): 485-505.
[14] VALEIRAS B, SIRI M V R, CODAGNONE M, et al. Gender influence on schizophrenia-relevant abnormalities in a cuprizone demyelination model [J]. Glia, 2014, 62(10):1629-1644.
Improvement on Mice Model of Cuprizone-induced Demyelination
TAN Biqin1, WENG Qinjie2, WANG Fei1, WANG Jiaying2, ZHAO Mengting2, ZHENG Jiahuan2, YAN Wei1*
(1.Department of Pharmacy,Hangzhou First People’s Hospital, Nanjing Medical University, Hangzhou 310006, China;2.Institute of Pharmacology and Toxicology, College of Pharmaceutical Sciences, Zhejiang University, Hangzhou 310058, China)
ABSTRACT:OBJECTIVE To improve the method of cuprizone(CPZ)-induced demyelinating mice model, and provide a more accurate and rapid animal model for the study on treatment of demyelinating disease. METHODS Sixty mice were averagely and randomly divided into control(i.g/d), CPZ induced model (300 mg·kg-1i.g/d, qd, bid, tid, qid) and CPZ traditional model (mixed with 0.2% cuprizone in the feed, and feeding 6 weeks), myelination was detected by immunohistochemical and LFB staining. The differences of acute demyelination in mice induced by CPZ gavage model and traditional model were compared. RESULTS The expression of myelin basic protein (MBP) was diminished significantly in CPZ-induced mice(i.g)for 3 weeks, but diminished in traditional demyelinating model for 6 weeks. The same results showed in LFB staining.CONCLUSION The improved mice model can shorten the time effectively and accurately, which showed obvious advantages.
KEY WORDS:cuprizone; demyelination; intragastric administration
REFERENCES
中图分类号:R965.1
文献标志码:A
文章编号:1007-7693(2017)10-1388-04
DOI:10.13748/j.cnki.issn1007-7693.2017.10.006
引用本文:谭笔琴, 翁勤洁, 王飞, 等. 双环己铜草酰二腙诱导的脱髓鞘小鼠造模方法的改进[J]. 中国现代应用药学, 2017,34(10): 1388-1391.
作者简介:谭笔琴,女,博士,药师 Tel: 15267181250 E-mail: biqintan@zju.edu.cn*
通信作者:严伟,女,主任药师 Tel:13456960476 Email: yanwei_115@163.com
收稿日期:2017-03-27
(本文责编:李艳芳)