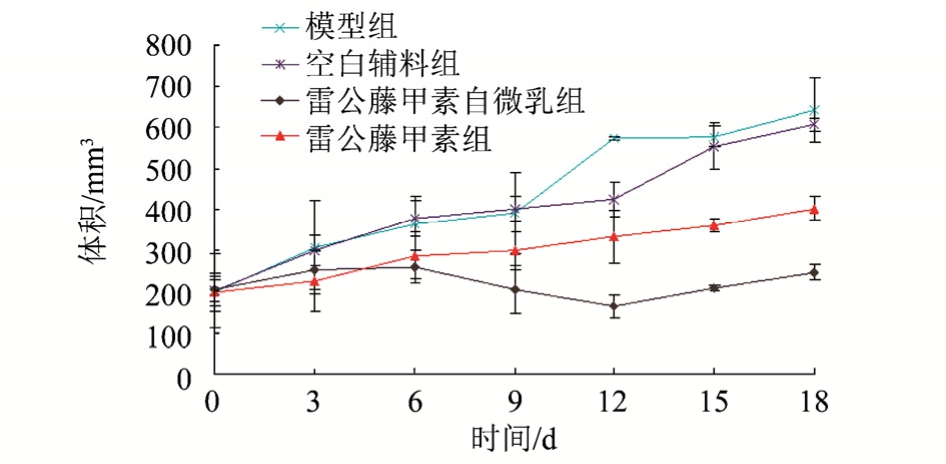
图1 肿瘤体积增长曲线(n=6)
Fig. 1 The growth curve of tumor volume(n=6)
吕华静1,李幸苗1,顾露囡2,蔡鑫君2*
(1.永康市第一人民医院药剂科,浙江 永康 321300;2.浙江省中西医结合医院药剂科,杭州 310003)
摘要:目的 研究雷公藤甲素自微乳对荷人前列腺癌PC-3细胞裸鼠移植瘤的抑制作用。方法 构建荷人前列腺癌 PC-3细胞裸鼠移植瘤,分为模型组、雷公藤甲素组、雷公藤甲素自微乳组、空白辅料组,灌胃给药,每2天1次,连续18 d,每3天测定瘤体积;给药结束后处死裸鼠,比较各组裸鼠的体质量、肝脏与瘤块质量,计算抑瘤率,并对瘤块组织中血管内皮生长因子(vascular endothelial growth factor,VEGF)进行免疫组化研究。结果 与模型组相比,雷公藤甲素和雷公藤甲素自微乳均可抑制肿瘤体积的增长;与雷公藤甲素相比,雷公藤甲素自微乳可以提高抑瘤率,降低肿瘤组织中VEGF的表达水平,对肿瘤抑制作用更佳,且未发现明显的毒性反应;空白辅料组对肿瘤无抑制作用。结论 自微乳给药系统可以提高雷公藤甲素的抗肿瘤作用,安全性良好。
关键词:雷公藤甲素;自微乳给药系统;PC-3细胞;抗肿瘤作用
雷公藤甲素(triptolide,TP)是中药雷公藤的主要活性成分,也称为雷公藤内酯醇,临床上常用于治疗自身免疫疾病,如红斑狼疮、类风湿性关节炎等[1]。近年来的研究发现,TP具有较好的抗肿瘤作用,特别是对乳腺癌、前列腺癌、黑色素瘤、胃癌等都有较好的效果[2-3]。但TP毒性较大,特别是对胃肠道刺激大、可能引起急性消化道出血等不良反应,同时其脂溶性较大,口服吸收差。因此亟需寻找一种新型的给药系统以提高药物的治疗效果[4-6]。
自微乳给药系统(self-microemulsifying drug delivery system,SMEDDS)作为一种新型的给药剂型,可以促进药物的经肠道吸收,提高药物的生物利用度并降低毒性,具有较好的应用前景[7-8]。本课题组在前期的研究中已成功制备出TP-SMEDDS[9]。本研究选择荷人前列腺癌 PC-3细胞裸鼠移植瘤为模型,研究其口服给药对荷人前列腺癌PC-3细胞裸鼠移植瘤的抑制作用,为TPSMEDDS进一步开发利用提供依据。
1.1 材料及试剂
人前列腺癌 PC-3细胞株购自中国科学院细胞库。BALB/c裸鼠(SPF级),♂,体质量22~25 g,鼠龄4~6周(由上海斯莱克实验动物有限责任公司提供,浙江大学动物中心养殖,实验动物使用许可证:SYXK2012-0178);血管内皮生长因子(vascular endothelial growth factor,VEGF)(150 µL,谷歌生物公司,批号:GB11034)。
1.2 方法
1.2.1 PC-3细胞培养 在常规二氧化碳培养箱中,以含 10%胎牛血清的 RM-1640培养液培养PC-3细胞。
1.2.2 移植瘤模型构建 取对数生长期的PC-3细胞,采用胰蛋白酶消化后用培养液调整细胞密度至2×107·mL-1。每只裸鼠背部皮下注射0.2 mL,约2×106个细胞。接种后隔日检查肿瘤形成情况。
1.2.3 分组与给药 PC-3细胞接种20 d后,挑选瘤体积相近的裸鼠随机分组,每组 6只。其中模型组不给予任何药物,每天给予正常饮食;TP组(0.4 mg·kg-1),TP-SMEDDS 组(相 当 于 TP 0.4 mg·kg-1),空白辅料组(不含药物的自微乳),灌胃给药,每2天1次,连续18 d;每3天测量瘤块体积,给药18 d后处死裸鼠,剥离瘤块并称重,按以下公式计算。
肿瘤体积=(肿瘤长径×肿瘤宽径2)/2
抑瘤率=(模型组平均瘤重-实验组平均瘤重)/模型组平均瘤重×100%。同时取裸鼠的肝脏进行称重,并将瘤块用甲醛固定,进一步进行免疫组化分析。
1.2.4 免疫组化实验 取固定好的瘤块进行组织切片,选择兔抗人 VEGF单克隆抗体,严格按照要求进行免疫组化分析,以棕黄色的强弱程度为观察指标,并对免疫组化结果进行光密度分析,比较各组之间的IOD值。
1.2.5 统计学处理 选择 SPSS 17.0统计软件进行统计分析,对独立样本进行t检验分析,当P<0.05时说明具有统计学意义。
2.1 不同给药组对荷瘤裸鼠的肿瘤抑制作用
给药后各给药组对移植瘤体积的增长都有抑制作用。其中TP组的抑制作用相对较差,肿瘤体积 从 (197.36±35.99)mm3增 长 到 了 (400.78±28.09)mm3;TP-SMEDDS组的肿瘤体积从(201.71±72.77)mm3增长到了(245.09±38.57)mm3;空白辅料组对肿瘤体积的增长基本无任何作用,肿瘤体积从(200.36±26.99)mm3增长到了(605.81±15.31)mm3,见图 1。
各给药组荷瘤裸鼠在给药后未见明显的活动减少、便秘、腹泻等不良反应。TP-SMEDDS对肿瘤的抑制率优于TP组,这可能是因为自微乳制剂有利于提高TP-SMEDDS的生物利用度,从而增强抗肿瘤效果。同时各组给药前后裸鼠的体质量并未出现明显的增加或减少,对裸鼠的肝脏也未见有明显的影响,提示自微乳剂型对裸鼠的毒性较小,空白自微乳辅料对肿瘤也没有抑制作用,结果见表1。

图1 肿瘤体积增长曲线(n=6)
Fig. 1 The growth curve of tumor volume(n=6)
表1 各组荷瘤小鼠体质量、肝脏质量、瘤块质量及抑瘤率的比较(n=6,x±s)
Tab. 1 Comparison of body weight, liver weight, tumor weight and tumor weight inhibition in tumor bearing mice(n=6,x±s)

注:与模型组比较,1)P<0.01;与TP组比较,2)P<0.05。
Note: Compared with model group,1)P<0.01; compared with TP group,2)P<0.05.
2.2 各给药组对瘤块组织中VEGF蛋白表达的影响
各给药组对瘤块组织中 VEGF蛋白的表达影响见图2,棕黄色表达越多,则VEGF蛋白的含量越高。为了进一步对其进行定量分析,笔者对免疫组化图进行了光密度分析,从 IOD值发现,VEGF蛋白IOD值在模型组中表达为(36 975.21±1 136.34)与空白辅料组(31 558.79±1 023.84)相当,VEGF蛋白在 TP组(17 234.22±2 013.54)与TP-SMEDDS组(9 976.12±1 230.21)的 IOD值明显低于模型组(P<0.01),而TP-SMEDDS组的IOD值明显低于TP组,具有统计学差异(P<0.05);提示TP-SMEDDS组抑制肿瘤新生血管的生成作用最强。
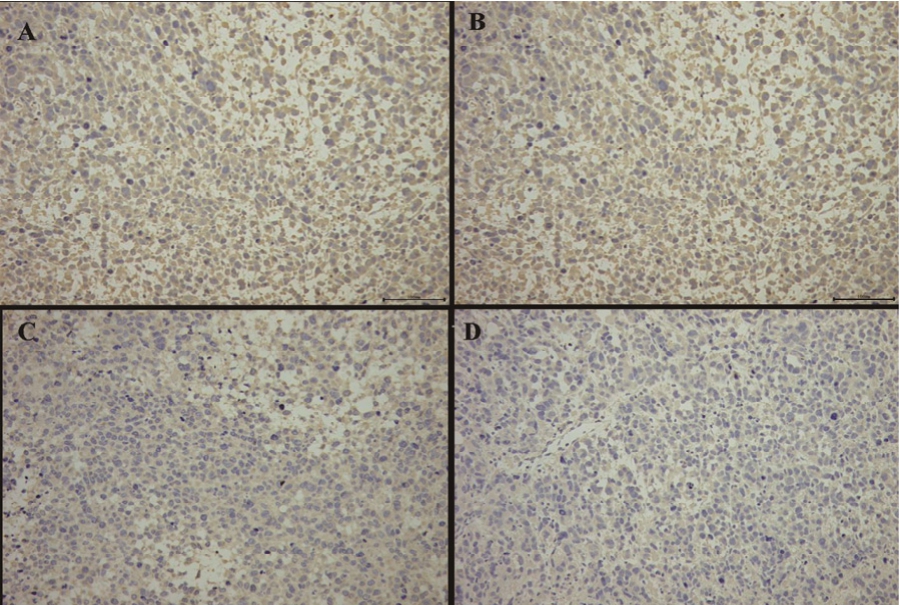
图2 VEGF蛋白在人前列腺癌PC-3组织中的表达(200×)
A-模型组;B-空白辅料组;C-TP组;D-TP-SMEDDS组。
Fig. 2 The expression of VEGF protein in different drug groups(200×)
A-model group; B-blank excipient group; C-TP group; D-TP-SMEDDS group.
SMEDDS是一种提高难溶性药物口服生物利用度的新型药物载体。本研究比较了常规口服TP和TP-SMEDDS对荷人前列腺癌PC-3细胞裸鼠移植瘤的抑制作用。研究结果发现,在相同给药剂量的情况下,TP-SMEDDS组对肿瘤体积增长的抑制作用优于 TP组;比较瘤重发现,TP-SMEDDS组的肿瘤质量明显低于模型组和空白辅料组(P<0.01),也低于 TP 组(P<0.05);比较抑瘤率发现,TP-SMEDDS组的肿瘤抑制率达到了 67.87%,显著高于TP组的24.15%。这可能的原因是SMEDDS有利于提高TP经肠道吸收,从而增加生物利用度,提高抗肿瘤疗效。因此需要进行相关药动学研究,进一步考察其在体内的组织分布情况。
由于SMEDDS中含有表面活性剂和助表面活性剂,可能存在毒性。本研究中考察空白辅料组对裸鼠的日常活动、给药前后的体质量的影响发现,并无明显的变化,并且对肿瘤体积的增长也无抑制作用,说明其具有一定的生物安全性,但是仍需进一步考察长期毒性以确定辅料的安全性。
本研究中的免疫组化结果佐证了TP-SMEDDS可能的抗肿瘤机制。通过免疫组化结果可知,TP和TP-SMEDDS均可降低肿瘤组织VEGF蛋白的表达,这揭示了TP抗肿瘤作用与抑制肿瘤血管形成,减少肿瘤组织获得氧气和营养的供应,达到抑制肿瘤生长的效果具有一定的相关性[8-9]。同时TP-SMEDDS组的 VEGF蛋白表达最低,可能是SMEDDS更有利于促进 TP吸收,提高了对肿瘤新生血管的抑制作用,从而增强抗肿瘤作用[10]。
[1] CHE K K, WANG L G, ZHANG R C, et al. Preparation and releasein vitroof triptolide-loaded poly (lactic-co-glycolic acid) microspheres for intra-articular injection [J]. Chin J New Drugs(中国新药杂志), 2016, 25(23): 2745-2749.
[2] DONG Z H. A study on anti-tumor activity of triptolide [J]. J Clin Med Pract(实用临床医药杂志), 2011, 15(1): 36-38.
[3] ZHANG Y, LI Z, BA W Q, et al. Dermal pharmacokinetic study of Fufang Leigongteng microemulsion gel by microdialysis combined with HPLC [J]. Pharm Today(今日药学), 2015, 25(9): 620-623.
[4] ZHANG Y M, ZHU L P. Retrospective analysis on hepatotoxicity, reproductive toxicity and hematotoxicity caused by tripterygium wilfordii preparations [J]. Chin J Drug Appl Monitor(中国药物应用与监测), , 2014, 11(3): 173-176.
[5] YU Y T, ZHU W F, JIN C, et al. Research progress of the dosage form improvement and administration mode of triptolide [J]. Chin J New Drugs(中国新药杂志), 2016, 25(12):1359-1362.
[6] YU Y T, ZHU W F, CHEN L H, et al. Preparation of Triptolide microemulsion-based gel and investigation of itsin vitropercutaneous permeability [J]. Chin J Hosp Pharm(中国医院药学杂志), 2016, 36(13): 1087-1091.
[7] ZHANG XF, MA J L, SHI J J, et al. Progress of quality evaluation of self-microemulsifying drug delivery system [J].Chin J Pharm(中国医药工业杂志) , 2016, 47(5): 637-647.
[8] XI J J, ZHANG J K, PAN X W, et al. Pharmacokinetics of artesunate self-microemulsion in rats [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2017, 34(3): 385-389.
[9] YANG R, LI H B, WANG B, et al. Inhibitory effects of triptolide and triptolide-loaded liposomes on angiogenesis [J].Acta Med Univ Sci Technol Huazhong(华中科技大学学报医学版), 2014, 43(2): 137-141.
[10] KONG X, ZHANG Y, LIU C, et al. Anti-angiogenic effect of triptolide in rheumatoid arthritis by targeting angiogenic cascade [J]. PLoS One, 2013, 8(10): e77513.
Inhibitory Effect of Triptolide Microemulsion on Human Prostate Cancer PC-3 Cell Line in Nude Mice
LYU Huajing1, LI Xingmiao1, GU Lunan2, CAI Xinjun2*
(1.Department of Pharmacy, the First Hospital of Yongkang,Yongkang 321300, China;2.Department of Pharmacy, Integrated Chinese and Western Medicine Hospital of Zhejiang Province,Hangzhou 310003, China)
ABSTRACT:OBJECTIVE To investigate the inhibitory effect of triptolide microemulsion on nude mice bearing human prostate cancer PC-3 cell. METHODS Nude mice xenografts beared human prostate cancer PC-3 cell were constructed, then these mice were divided into model group, triptolide group, triptolide microemulsion group and blank excipient group. The nude mice were administered orally, once every 2 days for 18 d, and their tumor volume was measured every 3 days. Then the nude mice were sacrificed at the end of administration; the body weight, liver and tumor weight of nude mice in each group were compared, the inhibition rate was calculated, further, the immunohistochemical study was carried out to detect the VEGF expression. RESULTS Compared with control group, triptolide and triptolide microemulsion group had obvious tumor growth inhibition effect; meanwhile, compared with triptolide group, triptolide microemulsion group could obviously down-regulat the expression level of VEGF in tumor tissue, and the effects of triptolide microemulsion on tumor inhibitory effect was better,furthermore, no obvious toxic reaction was found. The blank excipient group had no inhibitory effect on tumor. CONCLUSION Self microemulsion drug delivery system can enhance the anti-tumor effect of triptolide, and it is also relative safe.
KEY WORDS:triptolide; self emulsifying drug delivery system; PC-3 cells; antitumor effect
REFERENCES
中图分类号:R285.5
文献标志码:A
文章编号:1007-7693(2017)10-1385-03
DOI:10.13748/j.cnki.issn1007-7693.2017.10.005
引用本文:吕华静, 李幸苗, 顾露囡, 等. 雷公藤甲素自微乳对荷人前列腺癌裸鼠移植瘤的抑制作用研究[J]. 中国现代应用药学, 2017, 34(10): 1385-1387.
基金项目:杭州市科技发展计划项目(20130733Q14);浙江省中医药科技计划(2015ZA148)
作者简介:吕华静,女,主管药师 Tel: (0579)87575147 E-mail: 179652030@qq.com*
通信作者:蔡鑫君,男,硕士,主管药师Tel: (0571)56109869 E-mail: zjtcmcxj@163.com
收稿日期:2017-03-16
(本文责编:李艳芳)