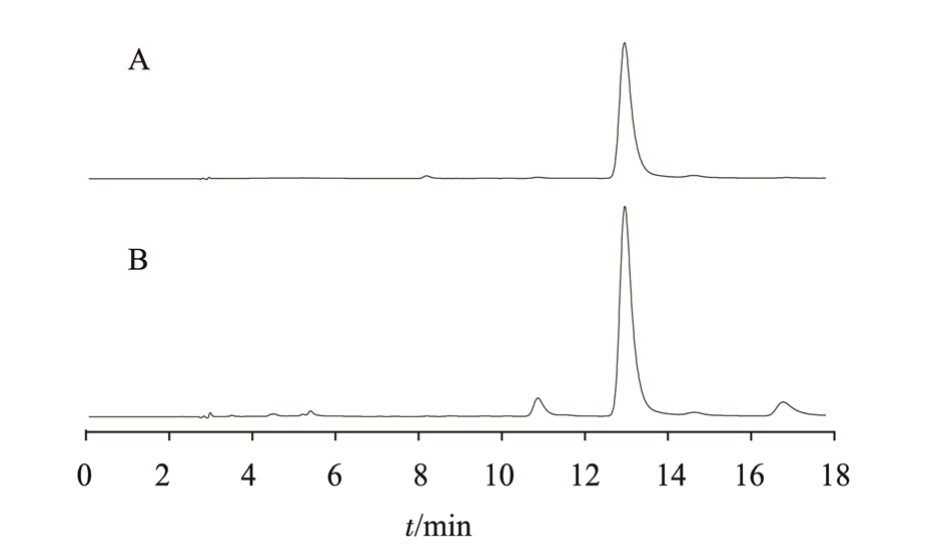
图1 HPLC图
A-对照品溶液;B-供试品溶液(以水为溶剂,100 ℃,1 h)。
Fig. 1 HPLC chromatogram
A-standard solution; B-sample solution (water as solvent, 100 ℃, 1 h).
吴吉1,喻叶楠2,张心怡2,於佳露2,吴家琪2,施菁2,崔勤敏2,吴永江3,栾连军3,施琦渊2*(1.杭州市食品药品检验研究院,杭州 310022;2.杭州医学院,杭州 310051;3.浙江大学,杭州 310058)
摘要:目的 考察影响化合物 3,5-O-二咖啡酰基奎宁酸稳定性的因素并对 3,5-O-二咖啡酰基奎宁酸的体外抗氧化活性进行初步研究。方法 采用HPLC考察3,5-O-二咖啡酰基奎宁酸在不同溶剂、pH、温度、光照条件下的稳定性;采用UV测定3,5-O-二咖啡酰基奎宁酸的体外抗氧化活性(清除DPPH自由基)。结果 溶剂的种类、pH值、温度、光照条件对3,5-O-二咖啡酰基奎宁酸稳定性具有一定影响。3,5-O-二咖啡酰基奎宁酸具有较强的体外清除DPPH自由基活性,其活性与Vc相当[3,5-O-二咖啡酰基奎宁酸和 Vc 的 IC50值分别为(372.56±1.04)μg·mL-1和(294.54±1.03)μg·mL-1]。结论 在该化合物的分离纯化及其分析检测时,不能采用纯有机溶剂为溶剂,应在中性或酸性条件下,低温、避光操作。3,5-O-二咖啡酰基奎宁酸作为抗氧化剂在制药、食品、化妆品以及精细化工行业具有广阔的应用前景。
关键词:3,5-O-二咖啡酰基奎宁酸;稳定性;抗氧化活性;奇蒿
咖啡酰奎宁酸类化合物,是一类由奎宁酸与数目不等的咖啡酸通过酯键连接而成的酚酸类天然产物,广泛存在于植物中,如:金银花、杜仲、白花刺参、小花鬼针草、咖啡豆、甘薯等[1]。现代药理学研究表明,3,5-O-二咖啡酰基奎宁酸具有较强的抗突变[2]、抗病毒(HBV、HIV[3-4]、RSV[5-6])、抗菌[6]、抗糖尿病、抗高血压[7]、抗氧化[8-11]、抗炎[12-13]、抗贾第虫[14]和止痛活性[15]。
因此,本课题组开展了从奇蒿(ArtemisiaanomalaS. Moore)中制备 3,5-O-二咖啡酰基奎宁酸的方法学研究。但在此过程中发现该化合物不稳定,难以得到纯品。因此,本研究采用 HPLC考察了各种因素对 3,5-O-二咖啡酰基奎宁酸稳定性的影响,以期发现能够使其稳定存在的条件,为今后的分离纯化、保存、药动学研究提供参考。并采用 UV考察了 3,5-O-二咖啡酰基奎宁酸清除DPPH自由基的活性,为其在医药、保健品、化妆品等领域的应用提供参考。
Agilent 1260高效液相色谱仪(美国Agilent公司),色谱柱为 Agilent Zorbax SB C18键合硅胶柱(250 mm×4.6 mm,5 µm);Newclassic MF型电子分析天平(瑞士梅特勒公司);DKS-26恒温水浴锅(常州诺基仪器有限公司);雷磁PHS-3C pH计(上海仪电科学仪器股份有限公司);ZF-6台式三用紫外分析仪(上海皓庄仪器有限公司)。
甲醇(分析纯,江苏强盛功能化学股份有限公司,批号:20131219);乙腈(色谱纯,美国TEDIA公司,批号:16065025);冰醋酸[色谱纯,阿拉丁试剂(上海)有限公司,批号:H1605015];水为超纯水,DPPH(分析纯,日本和光纯药工业株式会社,批号:ALE1299),维生素C[Vc,分析纯,阿拉丁试剂(上海)有限公司,批号:F1411017];对照品:3,5-O-二咖啡酰基奎宁酸为实验室自制,纯度为98.0%(峰面积归一化法测定)。
2.1 3,5-O-二咖啡酰基奎宁酸稳定性影响因素考察
2.1.1 色谱条件 流动相:乙腈-0.1%醋酸水(18∶82);检测波长:328 nm;柱温:40 ℃;流速:1.0 mL·min-1;进样量:10 μL。HPLC 图见图 1。

图1 HPLC图
A-对照品溶液;B-供试品溶液(以水为溶剂,100 ℃,1 h)。
Fig. 1 HPLC chromatogram
A-standard solution; B-sample solution (water as solvent, 100 ℃, 1 h).
2.1.2 不同溶剂中 3,5-O-二咖啡酰基奎宁酸的稳定性考察 分别以甲醇、乙醇、80%甲醇、80%乙醇、50%甲醇、50%乙醇、水为溶剂,配制100 μg·mL-13,5-O-二咖啡酰基奎宁酸溶液,常温避光放置,测定8 h内该化合物峰面积的变化,每个时间点重复测定3次。3,5-O-二咖啡酰基奎宁酸溶液在不同溶剂中的稳定性变化情况见图2。结果表明,不同溶剂对化合物的稳定性具有很大的影响,该化合物在水、50%甲醇、50%乙醇溶液中比较稳定,而在甲醇、乙醇、80%乙醇溶液中保留率较低。实验结果提示,在制备3,5-O-二咖啡酰基奎宁酸或进行相关制剂的生产和分析时,不宜用高浓度有机溶剂作为溶剂。
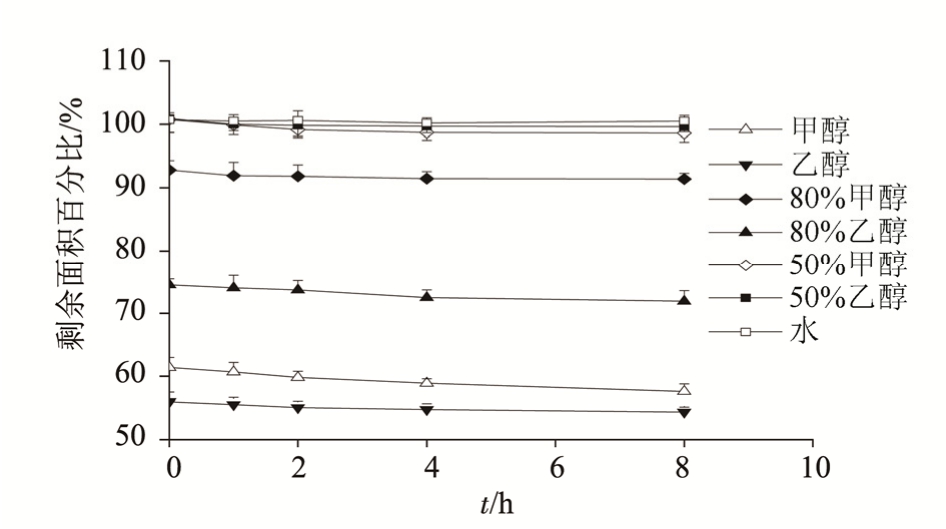
图2 不同溶剂中3,5-O-二咖啡酰基奎宁酸稳定性的影响
Fig. 2 The stability of 3,5-O-dicaffeoylquinic acid in different solvents
2.1.3 不同温度下 3,5-O-二咖啡酰基奎宁酸的稳定性考察 选择“2.1.2”中对化合物稳定性影响较小的水为溶剂,配制浓度为 100 μg·mL-1的3,5-O-二咖啡酰基奎宁酸溶液,分别避光放置在室温,40,60,80,100 ℃的恒温水浴锅中,测定10 h内该化合物峰面积的变化。结果见图3。
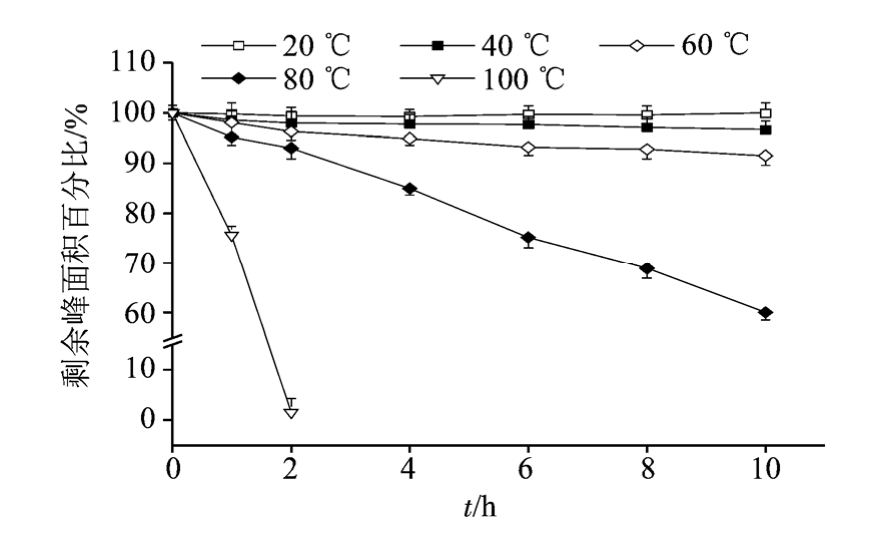
图3 不同温度对3,5-O-二咖啡酰基奎宁酸稳定性的影响
Fig. 3 The stability of 3,5-O-dicaffeoylquinic acid under different temperatures
由结果可知,温度对该化合物的稳定性有一定的影响。温度≤60 ℃,3,5-O-二咖啡酰基奎宁酸的剩余峰面积百分率变化不大。温度>60 ℃时,3,5-O-二咖啡酰基奎宁酸的剩余峰面积百分率变化明显增大。实验结果提示,在制备3,5-O-二咖啡酰基奎宁酸或进行相关制剂的生产和分析时,操作温度不宜>60 ℃。
2.1.4 不同pH值下3,5-O-二咖啡酰基奎宁酸的稳定性考察 取3,5-O-二咖啡酰基奎宁酸溶液,用稀盐酸和氢氧化钠调节为不同的pH值,观察pH值对3,5-O-二咖啡酰基奎宁酸稳定性的影响。
结果表明,3,5-O-二咖啡酰基奎宁酸在 pH 9~12的碱性条件下很不稳定,而在中性和酸性条件下稳定性相对较好,特别是在pH 4~7的酸性溶液中,化合物的稳定性良好。由此提示,可以通过调节溶液的pH值来提高其稳定性。3,5-O-二咖啡酰基奎宁酸溶液在pH为1,4,7,9和12时的稳定性变化情况见图4。
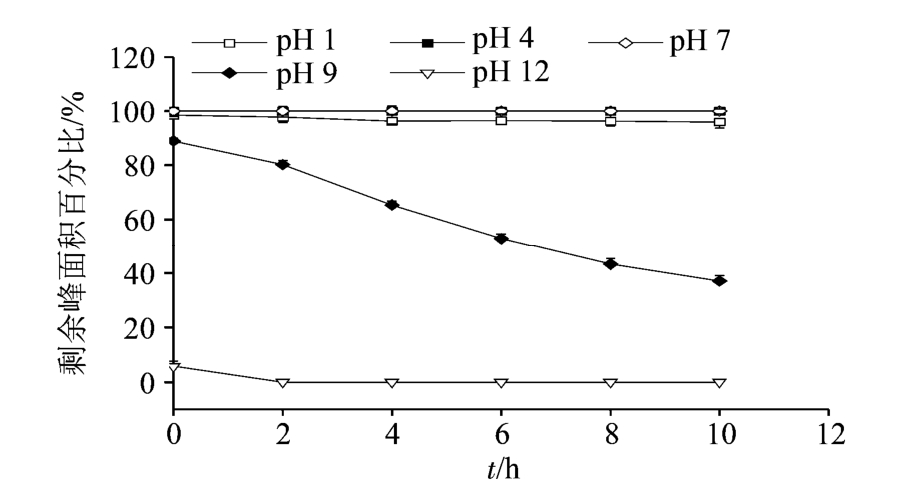
图4 不同pH值对3,5-O-二咖啡酰基奎宁酸稳定性的影响
Fig. 4 The stability of 3,5-O-dicaffeoylquinic acid at different pH values
2.1.5 不同光照条件下 3,5-O-二咖啡酰基奎宁酸的稳定性考察 配制浓度为100 μg·mL-1的3,5-O-二咖啡酰基奎宁酸溶液,分别置于暗处、日光灯、254 nm和365 nm的紫外灯下,测定6 h内该化合物峰面积的变化。
结果表明,化合物置于暗处,稳定性良好,而放置在日光灯下、254 nm、365 nm紫外灯下样品变化显著,尤其是前 4 h内剩余峰面积显著下降,但是4 h以后峰面积变化趋于平稳,结果见图5。
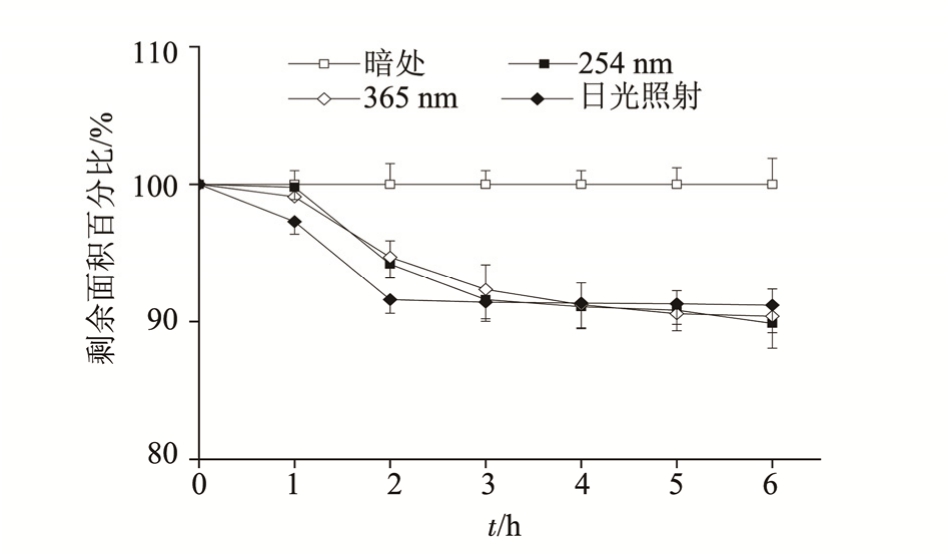
图 5 不同光照条件对 3,5-O-二咖啡酰基奎宁酸稳定性的影响
Fig. 5 The stability of 3,5-O-dicaffeoylquinic acid under different illuminations
2.2 3,5-O-二咖啡酰基奎宁酸清除 DPPH自由基活性考察
取3,5-O-二咖啡酰基奎宁酸和Vc适量,分别用蒸馏水配制一系列浓度供试品溶液。参照 Hsu等[16-17]报道的方法,测定3,5-O-二咖啡酰基奎宁酸的DPPH自由基清除活性。
取50 μL供试品溶液,加入到3 mL的DPPH的甲醇溶液(40 μg·mL-1)中,摇匀,室温下避光静置60 min后,在517 nm处,测其吸光度(Asample),同时测定50 μL蒸馏水与3 mL的DPPH溶液混合后的吸光度(Acontrol),以及 50 μL供试品溶液与3 mL甲醇混合后的吸光度(Ablank),按下式计算DPPH清除率(%),并计算IC50值。
DPPH清除率(%)=[(Acontrol-Asample)/Acontrol]×100%
3,5-O-二咖啡酰基奎宁酸和阳性对照 VC的DPPH自由基清除实验结果见图 6。3,5-O-二咖啡酰基奎宁酸和 Vc的 IC50值分别为(372.56±1.04)μg·mL-1和 (294.54±1.03)μg·mL-1(拟 合 度P<0.05)。由此可见,3,5-O-dicaffeoylquinic acid表现出较强的DPPH自由基清除活性,其IC50与Vc相仿。
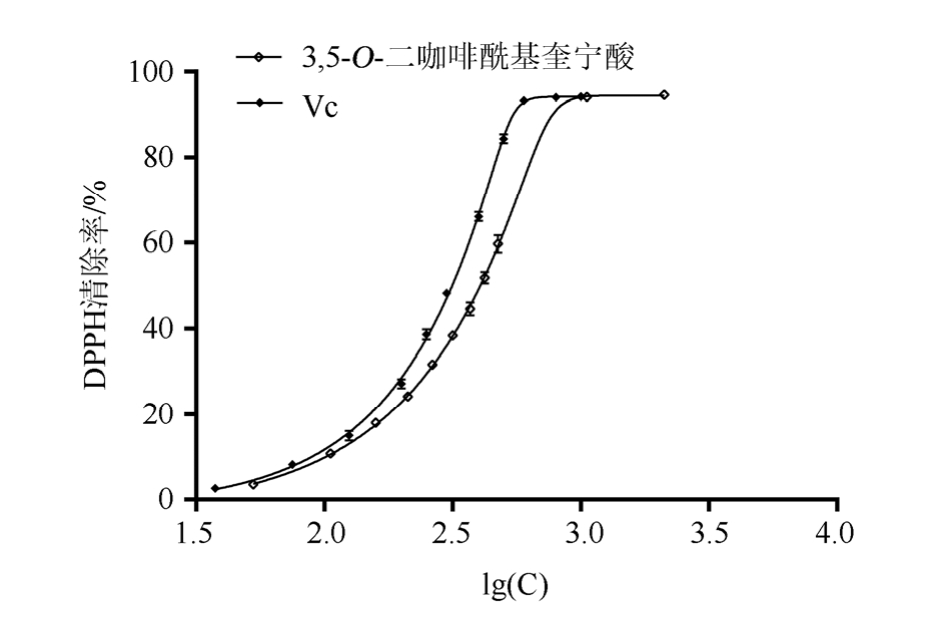
图6 3,5-O-二咖啡酰基奎宁酸和Vc的DPPH自由基清除实验结果(n=3)
Fig. 6 DPPH radical scavenging assay of 3,5-O-dicaffeoyl quinic acid and Vc (n=3)
3,5-O-二咖啡酰基奎宁酸是由咖啡酸和奎宁酸缩合的缩酚酸,具有酯键和多酚羟基结构。酯键结构具有水解性,易在碱性条件下,发生水解反应。多酚羟基结构,具有还原性,易受空气中的氧、温度和光照的影响,易被氧化。
研究结果表明,3,5-O-二咖啡酰基奎宁酸经不同溶剂、pH值、温度、光照条件处理,整体上表现出良好的稳定性,但在高浓度有机溶剂(浓度≥80%)、碱性(pH值≥9)、高温(温度≥80 )℃、光照(日光、254 nm和365 nm)条件下稳定性有所降低。在该化合物的分离纯化及其分析检测时,不能采用纯有机溶剂为溶剂,应在中性或酸性条件下,低温、避光操作。
3,5-O-二咖啡酰基奎宁酸具有较强的体外清除 DPPH自由基活性,其活性与 Vc相当[3,5-O-二咖啡酰基奎宁酸和 Vc的 IC50值分别为(372.56±1.04)μg·mL-1和(294.54±1.03)μg·mL-1]。3,5-O-二咖啡酰基奎宁酸作为抗氧化剂在制药、食品、化妆品以及精细化工行业具有广阔的应用前景。
[1] 朱乃亮, 彭平, 赵丽敏, 等. 植物中常见咖啡酰奎宁酸类化合物研究进展[C]. 中华中医药学会中药化学分会学术年会,2013.
[2] YOSHIMOTO M, YAHARA S, OKUNO S, et al.Antimutagenicity of mono-, di-, and tricaffeoylquinic acid derivatives isolated from sweetpotato (Lpomoea batatasL. )leaf [J]. Biosci Biotechnol Biochem, 2002, 66(11): 2336-2341.
[3] ZHU K, CORDEIRO M L, ATIENZA J, et al. Irreversible inhibition of human immune- deficiency virus type 1 integrase by dicaffeoylquinic acids [J]. J Virol, 1999, 73(4): 3309-3316.
[4] JR R W, CORDEIRO M, ABDEL-MALEK S, et al.Dicaffeoylquinic acid inhibitors of human immunodeficiency virus integrase: inhibition of the core catalytic domain of human immunodeficiency virus integrase [J]. Mol Pharmacol,1996, 50(4): 846-855.
[5] LI Y L, BUT P P H, OOI V E C. Antiviral activity and mode of action of caffeoylquinic acids fromSchefflera heptaphylla(L.) Frodin [J]. Antiviral Res, 2005, 68(1): 1-9.
[6] OOI L S M, WANG H, HE Z D, et al. Antiviral activities of purified compounds fromYoungia japonica(L. ) DC(Asteraceae, Compositae) [J]. J Ethnopharmacol, 2006, 106(2):187-191.
[7] SIMEONOVA R, BURDINA M K, DIMITROVA D Z, et al.Antidiabetic, antioxidant and antihypertensive effects of 3,5-dicaffeoylquinic acid fromGeigeria alata(Dc) Oliv. &Hiern. on streptozotocin-induced diabetic normotensive and hypertensive rats [J]. Toxicol Lett, 2016(258): S293.
[8] KIM J Y CHO J Y, MA Y K, et al. Dicaffeoylquinic acid derivatives and flavonoid glucosides from glasswort(Salicornia herbaceaL. ) and their antioxidative activity [J].Food Chem, 2011, 125(1): 55-62.
[9] OHNISHI M, MORISHITA H, IWAHASHI H, et al.Inhibitory effects of chlorogenic acids on linoleic acid peroxidation and haemolysis [J]. Phytochemistry, 1994, 36(3):579-583.
[10] FU Z F, TU Z C, ZHANG L, et al. Antioxidant activities and polyphenols of sweet potato (Ipomoea batatasL. ) leaves extracted with solvents of various polarities [J]. Food Biosci,2015(15): 11-18.
[11] KÖNCZÖL A, BÉNI Z, SIPOS M M, et al. Antioxidant activity-guided phytochemical investigation ofArtemisia gmeliniiWebb. ex Stechm. : isolation and spectroscopic challenges of 3, 5-O-dicaffeoyl (epi?) quinic acid and its ethyl ester [J]. J Pharm Biomed Anal, 2012, 59(1): 83-89.
[12] ZHONG R F, XU G B, WANG Z, et al. Identification of anti-inflammatory constituents fromKalimeris indicawith UHPLC-ESI-Q-TOF-MS/MS and GC-MS [J]. J Ethnopharmacol, 2015(165): 39-45.
[13] CHEN X, MIAO J S, WANG H, et al. The anti-inflammatory activities ofAinsliaea fragransChamp. extract and its components in lipopolysaccharide-stimulated RAW264. 7 macrophages through inhibition of NF-κB pathway [J]. J Ethnopharmacol, 2015(170): 72-80.
[14] ZHANG Y H, XUE M Q, BAI Y C, et al. 3,5-Dicaffeoylquinic acid isolated fromArtemisia argyiand its ester derivatives exert anti-Leucyl-tRNA synthetase ofGiardia lamblia(GlLeuRS) and potential anti-giardial effects [J].Fitoterapia, 2012, 83(7): 1281-1285.
[15] DOS SANTOS M D, GOBBO-NETO L, ALBARELLA L, et al. Analgesic activity of di-caffeoyl- quinic acids from roots ofLychnophora ericoides(Arnica da serra) [J]. J Ethnopharmacol,2005, 96(3): 545-549.
[16] HSU C F, ZHANG L J, PENG H, et al. Scavenging of DPPH free radicals by polypyrrole powders of varying levels of overoxidation and/or reduction [J]. Synthetic Metals, 2008,158(21): 946-952.
[17] ZHAO X Y. Optimization of extraction of total flavonoids fromSalvia miltiorrhizaBge. by response surface analysis and evaluation of its antioxidant activityin vitro[J]. Chin J Mod Appl Pharm(中国现代应用药学), 2017, 34(5): 686-691.
Study on the Stability and Antioxidant Activity of 3,5-O-Dicaffeoylquinic Acid
WU Ji1, YU Yenan2, ZHANG Xinyi2, YU Jialu2, WU Jiaqi2, SHI Jing2, CUI Qinmin2, WU Yongjiang3, LUAN Lianjun3, SHI Qiyuan2*
(1.Hangzhou Institute for Food and Drug Control, Hangzhou 310022, China; 2.Hangzhou Medical College, Hangzhou 310051, China; 3.Zhejiang University, Hangzhou 310058, China)
ABSTRACT:OBJECTIVE To investigate the factors influencing the stability of 3,5-O-dicaffeoylquinic acid and investigate the antioxidant activity of 3,5-O-dicaffeoylquinic acidin vitro. METHODS The stability of 3,5-O-dicaffeoylquinic acid in different solvents, temperatures, pH values, and illuminations were measured by HPLC. And its antioxidant activity (DPPH free radical scavenging capacity) was measured by UV. RESULTS The stability of 3,5-O-dicaffeoylquinic acid was influenced by the solvent, pH value, temperature and illumination. 3,5-O-dicaffeoylquinic acid showed strong DPPH free radical scavenging capacity [3,5-O-dicaffeoylquinic acid’s IC50value was (372.56±1.04)μg·mL-1, Vc’s was (294.54±1.03)μg·mL-1].CONCLUSION It is recommended to be stored in acidic aqueous solution under low temperature and light protection condition during the separation, purification and analytical process. 3,5-O-dicaffeoylquinic acid will have broad application prospects in pharmaceutical, foodstuff, cosmetics and fine chemicals industries as an antioxidant.
KEY WORDS:3,5-O-dicaffeoylquinic acid; stability; antioxidant activity;Artemisia anomalaS. Moore
REFERENCES
中图分类号:R917
文献标志码:B
文章编号:1007-7693(2017)10-1397-04
DOI:10.13748/j.cnki.issn1007-7693.2017.10.008
引用本文:吴吉, 喻叶楠, 张心怡, 等. 3,5-O-二咖啡酰基奎宁酸的稳定性和抗氧化活性研究[J]. 中国现代应用药学, 2017,34(10): 1397-1400.
基金项目:浙江省医药卫生科技计划项目(2017KY311);浙江省科技计划项目(2015C31048);浙江省教育科学规划研究课题(2017SCG030)
作者简介:吴吉,女,硕士,主管药师 Tel: (0571)85460780 E-mail: 20535275@qq.com*
通信作者:施琦渊,男,博士,讲师 Tel:(0571)87692881 E-mail: shiqiyuan@hmc.edu.cn
收稿日期:2017-03-13
(本文责编:李艳芳)