
图1 HBoV 1~4型序列比对结果(用MEGA软件查看比对结果的部分截图)
Fig. 1 HBoV 1-4 sequence alignment results (using MEGA software to see partial screenshots of the alignment results)
余燕,梁蔚阳*,邓锋
(广东省药品检验所,广州 510180)
摘要:目的 开发快捷方便的检测人博卡病毒(human bocavirus,HBoV)方法,并调查华南地区血液制品和原料血浆中的污染情况。方法 建立HBoV的TaqMan探针实时荧光定量PCR方法,并对相关血液制品企业提供的单人份血浆和原料血浆样品、人血白蛋白、静脉注射免疫球蛋白(intravenous immunoglobulin,IVIG)、人纤维蛋白原、人凝血因子Ⅷ及人纤维蛋白胶-人纤维蛋白原中HBoV的污染情况进行检测。结果 HBoV-DNA在原料血浆和人凝血因子Ⅷ样本中的检测率分别为5.2%和5.0%,但在其他血液制品中则没有检出。结论 本研究建立的基于TaqMan探针HBoV的实时荧光定量PCR方法可以很好地检测出原料血浆及血液制品中的HBoV,对于血液制品的病毒安全有重要意义。
关键词:博卡病毒;血液制品;检测方法;人凝血因子Ⅷ
人博卡病毒(human bocavirus,HBoV)是2005年由 Allander等在儿童呼吸道分泌物中发现的一种新型线性单链DNA的细小病毒[1]。2009—2010年在腹泻患者粪便样本中相继发现了 HBoV-2、HBoV-3和 HBoV-4几个基因分型[1]。几种分型HBoV均可引发儿童及低免疫人群的呼吸或消化系统感染[2-4]。全球多个国家和地区已有检测到感染病例的报道,检出率约为1.5%~19%,且近年来在健康献血人群血液筛查时也频频发现[5-8]。由于HBoV发现时间较晚,目前对其致病机制和传播方式仍存在争议,国内外尚无原料血浆和血液制品中HBoV的标准检测方法及载量限制[9-10],相关生产企业也未有质控标准,已有生产处理工艺对它的灭活效果也未见报道。本研究建立了基于TaqMan探针的实时荧光定量PCR方法,并采用该方法对从血液制品企业收集的单人份血浆、原料血浆样品和相关血液制品进行了检测,对 HBoV在中国健康人群中的流行情况、现有血液制品生产工艺对HBoV的灭活效果进行初步评价。
1.1 样品
136份单人份血浆和原料血浆均由华南地区相关血液制品制造企业甲公司提供;30批人血白蛋白、10批静脉注射免疫球蛋白(intravenous immunoglobulin,IVIG)是在管辖范围内批签发检品中随机抽取;10批IVIG、6批人纤维蛋白原、20批人凝血因子Ⅷ及6批人纤维蛋白胶-人纤维蛋白原由华南地区相关血液制品制造企业乙公司提供。
1.2 试剂与仪器
Ultrospec 2100核酸蛋白快速测定仪(Amersham Biosciences);5804R低温冷冻离心机(Eppendorf公司);7300型荧光定量 PCR仪(ABI公司);生物安全柜(美国Thermo)。
QIAmp DNA Blood Mini Kit DNA提取试剂盒(Qiagen公司,批号:51106);质粒提取试剂盒(北京天根生物有限公司,批号:DP103-5);质粒P-Huboca由广东省疾病预防控制中心构建并惠赠;琼脂糖(美国Invitrogen公司,批号:95510-015)。
1.3 HBoV-DNA 的检测
1.3.1 引物和探针 随机选取 Genbank收录的 4条HBoV-1序列、HBoV-2、HBoV-3序列各3条以及2条HBoV-4序列,通过ClustalX 1.83进行序列比对,并将结果采用MEGA 5.0进行分析;查看比对结果,选取 Hbov1~4序列比对结果所示同源性较高区域,结果见图1,通过Primer-Primer 5.0设计符合PCR反应条件的Real-time PCR引物,同时考虑这段序列应符合实时定量PCR的引物及探针设计要求。根据前期研究和软件计算,合成引物和探针见表 1,并交由上海生物工程有限公司合成。
1.3.2 病毒核酸 DNA 的提取 按试剂盒说明书操作。
1.3.3 阳性标准品的制备 通过常规PCR进行扩增HBoV阳性标本DNA,产物经琼脂糖凝胶电泳,切胶后纯化扩增片段;纯化的扩增产物用Quant-iT DNA结合分光光度法进行定量测定。将PCR扩增产物与P-Huboca载体在T4连接酶的作用下进行连接反应;将连接好重组质粒 P-Huboca-T-HBoV转化入大肠杆菌 DH5α感受态细胞内,并通过扩增培养进行转化子的筛选;最终对筛选出的全基因合成的阳性质粒进行提取、扩大培养和纯化从而得到阳性标准品。
1.3.4 PCR反应体系及反应条件 PCR扩增的反应体系:2Xprobe Mix 12.5 μL、酶 0.25 μL、HBoV-F/R(10 μmol·L-1) 各 1 μL 、 HBoV-p(5 μmol·L-1)各 1 μL、DNA 5 μL、双蒸水 4.25 μL,总反应体积为25 μL。反应条件:50 ℃,30 min,然后以 95 ℃,2 min;95 ℃,5 s;56 ℃,50 s 进行40个循环。
1.4 实时定量PCR的特异性
采用上述设计引物及建立的方法,分别对HBoV阳性对照及细小病毒 B19的病毒核酸提取液进行扩增,仅 HBoV阳性对照提取液扩增出条带,细小病毒 B19的病毒核酸提取液及阴性对照均未扩增出阳性条带,表明本引物对HBoV DNA具有特异性。
1.5 实时定量PCR的线性
取阳性标准品按 10倍梯度稀释,取稀释液1 µL进行实时荧光 PCR扩增检测,以各供试品Ct值为Y轴,浓度的lg值为X轴,建立线性回归方程,计算相关系数,并设阴性对照。

图1 HBoV 1~4型序列比对结果(用MEGA软件查看比对结果的部分截图)
Fig. 1 HBoV 1-4 sequence alignment results (using MEGA software to see partial screenshots of the alignment results)
表1 HBoV荧光定量PCR引物与探针设计
Tab. 1 Design of HBoV fluorescent quantitative PCR primers and probes
1.6 检测限
在线性关系项下的各梯度DNA稀释液的扩增结果中,能扩增出阳性结果的最小DNA浓度即为检出限浓度,经试验,检测限浓度分别为10 copies·μL-1。
2.1 特异性
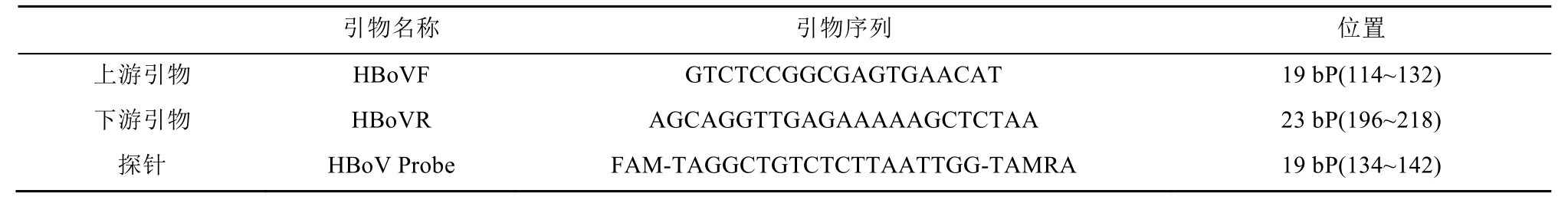
在同一条件下,将阳性标准品、HBoV、B19病毒核酸同时应用建立的方法进行扩增检测,结果阳性标准品在扩增检测时都有明显检测,B19病毒核酸和阴性对照检测结果均为阴性。结果见图2,实验表明该方法特异性较好。

图2 实时荧光定量PCR的特异性
A-阳性标准品;B-HBoV阳性血浆;C-B19阳性血浆。
Fig. 2 Specificity of real-time fluorescent quantitative PCR
A-the positive standard; B-HBoV positive plasma; C-B19 positive plasma.
2.2 线性
将制备的阳性标准品以10倍梯度稀释,将6个稀释度作为模板进行荧光定量PCR扩增,结果见图 3,DNA 提取液从 101~106copies·μL-1至最低浓度呈现良好的线性关系,结果见图4,根据扩增后所得的Ct值及相应拷贝数的lg值,得到标准曲线方程式为y=4.706x+43.35,相关系数r=0.997 5。
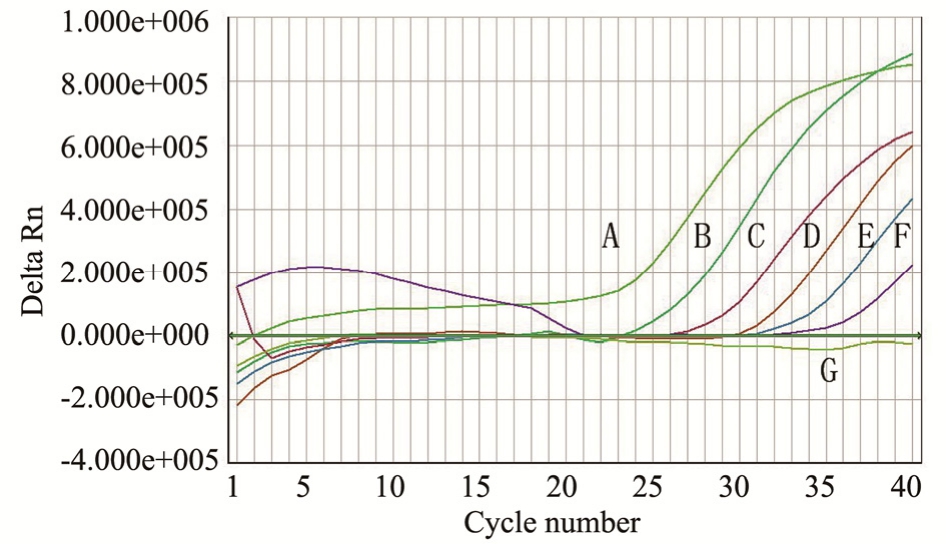
图3 实时荧光定量PCR的线性
A~F 分别对应 106,105,104,103,102,10 copies·μL-1;G 为 NTC。
Fig. 3 Linearity of real-time fluorescent quantitative PCR
A-F refers to 106, 105, 104, 103, 102, 10 copies·μL-1, respectively;G-NTC.
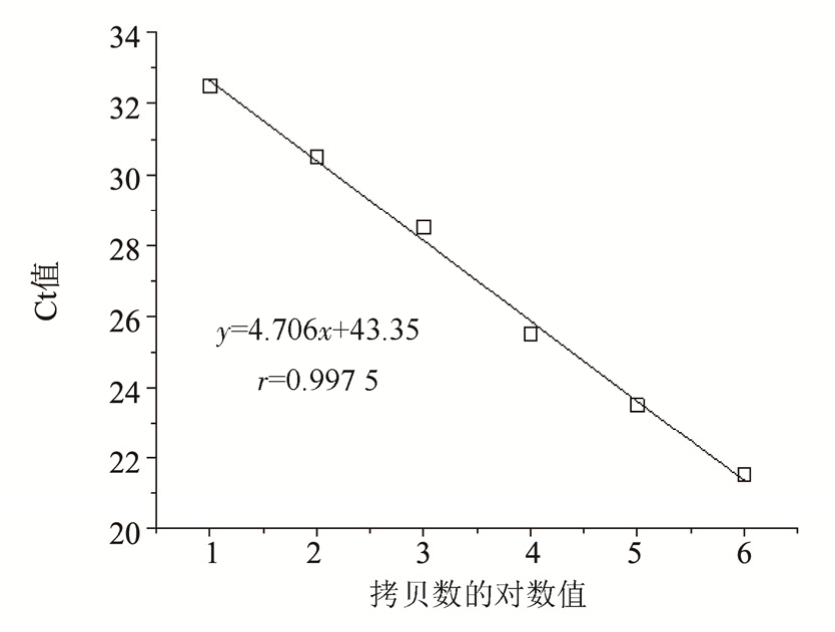
图4 实时荧光定量的标准曲线
Fig. 4 Standard curves for real-time fluorescence quantification
2.3 检测限
根据标准曲线的实验结果可知,检测限浓度为 10 copies·μL-1。
2.4 样品检测结果
利用该方法对国内相关血液制品企业提供的136份单人份血浆和原料血浆样品、30批人血白蛋白、10批IVIG、6批人纤维蛋白原、20批人凝血因子Ⅷ及6批人纤维蛋白胶-人纤维蛋白原进行检测。结果表明,HBoV-DNA在原料血浆和人凝血因子Ⅷ样本中的检出率分别为5.2%和5.0%,而在人血白蛋白、IVIG、人纤维蛋白原、人纤维蛋白胶-人纤维蛋白原等几种血液制品中则没有检出。
经过多家生产企业的实地调研,发现人凝血因子Ⅷ由于热稳定性差,不宜采用其他血液制品所广泛使用的灭活效率高的干热或湿热灭活法,目前多采用低温乙醇或冷冻法制备。以 HBoV为代表的细小病毒耐低温性强,并易于包被在大分子蛋白质(分子量约200~500万)中,大大减轻了后续化学消毒如亚甲蓝光化学处理、短波紫外消毒等对其损伤效应,降低了去除效果,故而本研究中人凝血因子Ⅷ样本的检出率较高。研究和开发高效安全,同时对生物活性影响小的消毒方法已成为控制HBoV污染、保障产品质量的重要需求。
HBoV是细小病毒家族中继人细小病毒 B19和PARV4后第3个可导致人类疾病的细小病毒。细小病毒直径小、无包膜,易于透过滤膜膜孔,故过滤法很难将其有效去除。有文献证实,即使采用 S/D法和干热灭活法处理后的血液制品中也可发现HBoV,表明HBoV可经由血液制品传播;另一种细小病毒PARV4也被证实可通过滤膜法和热灭活法处理的凝血因子Ⅷ传播[4,7,9-10]。笔者在前期研究中也发现,B19在部分血液制品中检出率最高可达 0.3%~0.5%[11]。然而关于 HBoV与经血液传播相关研究在国内尚未见报道。鉴于与人细小病毒 B19在结构大小、生物学活性、流行病学等方面有相似之处,HBoV是否对血液制品也构成安全威胁?因此建立 HBoV的高效快捷的标准检测方法,用于监测原料血浆及相关生物制品受到HBoV污染情况,分析经由生物制品传播的风险已迫在眉睫。本研究建立的 TaqMan实时荧光定量PCR方法具有特异性好,灵敏度高等优点,可以用于血液制品的病毒安全性监督预警,规范指导企业生产。但由于时间和人力限制,本研究的标本量及种类数目仍较为有限,导致无法对标本进行系统发育分析。在今后的研究中,要进一步加大样本容量,以更好地了解HBoV健康献浆人群、原料血浆及血液制品中的基因组和血清学抗体流行特征,为更全面的探索是否可能对血液安全造成威胁提供资料。此外,如何强化现有消毒处理,研究和开发高效安全的,对人凝血因子Ⅷ的生物活性影响较小的消毒方法是控制 HBoV等细小病毒污染、保障产品质量的关键问题。
[1] AILANDER T, JARTTI T, GUPTA S, et al. Human bocavirus and acute wheezing in children [J]. Clin Infect Dis, 2007, 44(7):904-910.
[2] BONVICINI F, MANARESI E, GENTILOMI G A, et al.Evidence of human bocavirus viremia inhealthy blood donors[J]. Diagn Microbiol Infect Dis, 2011, 71(4): 460-462.
[3] POOLE B D, KARETNYI Y V, NAIDES S J. Parvovirus B19-induced apoptosis of hepatocytes [J]. J Virol, 2004,78(14): 7775-7783.
[4] SLOOTS T P, MC ERLEAN P, SPEICHER D J, et al.Evidence of human coronavirus HKU1 and human bocavirus in Australian children [J]. J Clin Virol, 2006, 35(1): 99-102.
[5] KESEBIR D, VAZQUEZ M, WEIBEL C, et al. Human bocavirus infection in young children in the United States:molecular epidemiological profile and clinical charac-teristics of a newly emerging respiratory virus [J]. J Infect Dis, 2006,194(9): 1276-1282.
[6] WEISSBRICH B, NESKE F, SCHUBERT J, et al. Frequent detection of bocavirus DNA in German children with respiratory tract infections [J]. BMC Infect Dis, 2006(6): 109.
[7] MA X M, ENDO R, ISHIGURO N, et al. Detection of human bocavirus in Japanese children with lower respiratory tract infections [J]. J Clin Microbiol, 2006, 44(3): 1132-1134.
[8] LIN F, GUAN W, CHENG F, et al. ELISAs using human bocavirus VP2 virus-like particles for detection of anti-bodies against HBoV [J]. J Virol Methods, 2008, 149(1): 110-117.
[9] LU X, CHITTAGANPITCH M, OLSEN S J, et al. Real-time PCR assays for detection of bocavirus in human specimens [J].J Clin Microbiol, 2006, 44(9): 3231-3235.
[10] NESKE F, BLESSING K, TOLLMANN F, et al. Real-time PCR for diagnosis of human bocavirus infections and phylogenetic analysis [J]. J Clin Microbiol, 2007, 45(7):2116-2122.
[11] ZHENG R B, YU Y. Testing and analysis of human bocavirus B19 gene in blood products [J]. China Med Pharm(中国医药科学), 2015, 5(13): 151-153.
Development of PCR Method Using TaqMan Probe for the Detection of Human Bocavirus and Investigation of Pollution of Blood Products and Raw Plasma
YU Yan, LIANG Weiyang*, DENG Feng
(Guangdong Institute for Drug Control, Guangzhou 510180, China)
ABSTRACT:OBJECTIVE To develop a quick and convenient method for detection of human bocavirus (HBoV), and investigate the pollution situation of blood products and raw plasma in south of China. METHODS Real time fluorescence quantitative PCR using TaqMan probe was established. Blood products collected from different manufacturer including original single plasma and raw plasma samples, serum albumin, intravenous injection of immune globulin protein (IVIG), fibrin raw and human clotting factor Ⅷ and human fibrinogen fibrin glue to human fibrin were checked. RESULTS The detection rate of HBoV-DNA in raw plasma samples and human clotting factor Ⅷ were 5.2% and 5.0% respectively. But no HBoV-DNA was detected in other blood products. CONCLUSION PCR method developed in this thesis is qualified to test HBoV-DNA in blood products and raw plasma, which is of great significance to the standardized production and medication safety.
KEY WORDS:human bocavirus(HBoV); blood products; test method; human clotting factor Ⅷ
REFERENCES
中图分类号:R915
文献标志码:B
文章编号:1007-7693(2017)10-1451-04
DOI:10.13748/j.cnki.issn1007-7693.2017.10.019
引用本文:余燕, 梁蔚阳, 邓锋. 人博卡病毒荧光定量PCR方法(TaqMan探针法)的建立及其在血液制品污染情况调查中的应用[J]. 中国现代应用药学, 2017, 34(10): 1451-1454.
基金项目:广东省科技计划项目(2014A020218011,2016A040403076);越秀区科技计划项目(2015PT004)
作者简介:余燕,女,硕士,副主任药师 Tel: 13580351697 E-mail: 494409425@qq.com*
通信作者:梁蔚阳,女,硕士,主任药师 Tel: 13580351697 E-mail: 494409425@qq.com
收稿日期:2017-02-04
(本文责编:李艳芳)