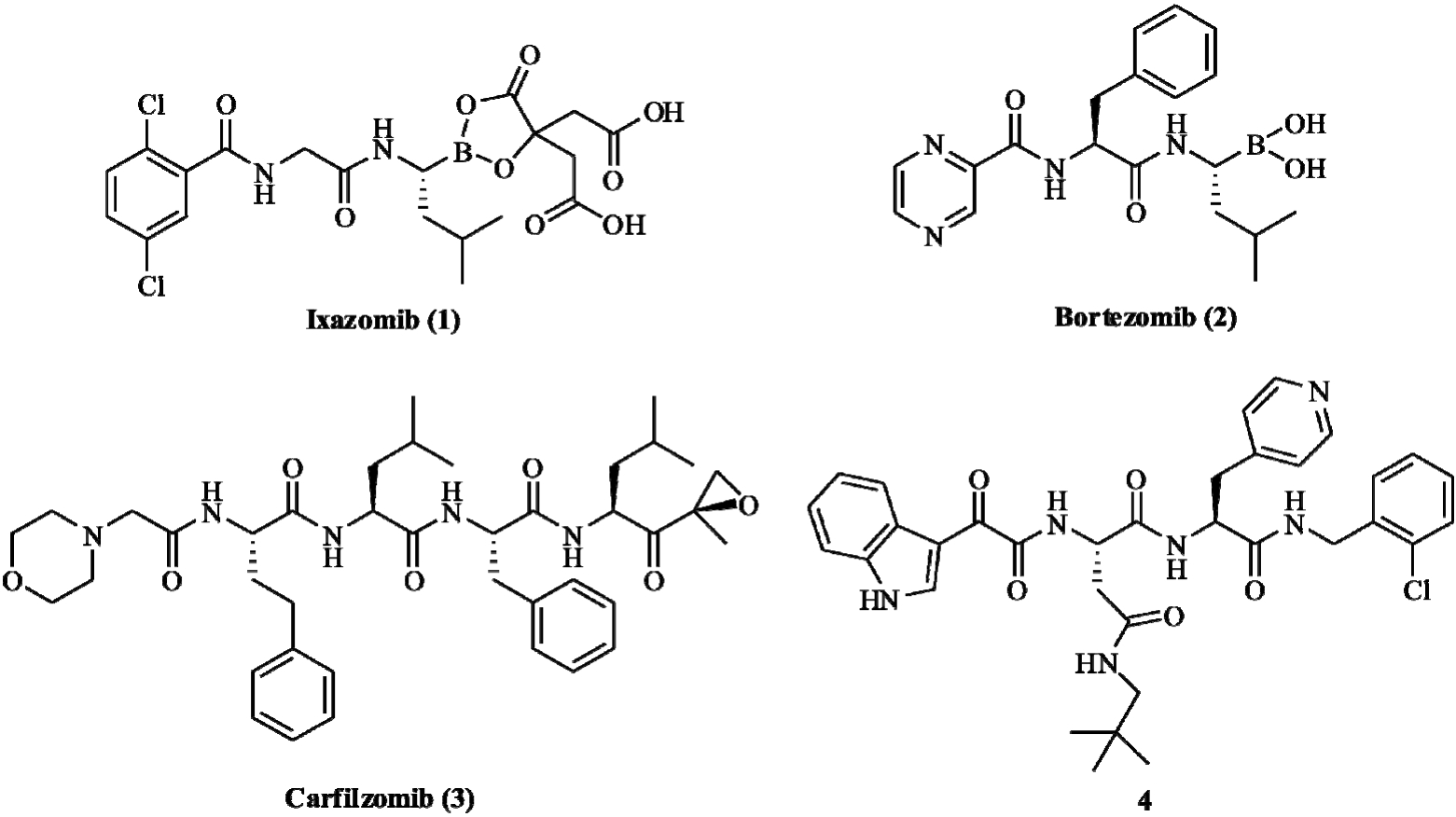
图1 已上市及代表性非共价结合蛋白酶体抑制剂的结构式
Fig. 1 Structures of the approved (1, 2 and 3) and representative non-covalent (4) proteasome inhibitors
席建军,张建康*,赵艳梅,何若愚,庄让笑,潘金明,黄玮玮,刘寿荣*
(杭州市西溪医院,杭州 310023)
摘要:目的 设计、合成系列非共价结合拟肽类蛋白酶体抑制剂,并对其进行活性评价。方法 根据非共价结合蛋白酶体抑制剂与蛋白酶体的结合特点,采用氨基酸替换、生物电子等排等经典的药物设计方法,选取邻氯苄胺作为化合物的羧基末端基团,同时在肽骨架结构中引入六元环以增强肽类化合物的稳定性,设计并合成了一系列短肽非共价结合类蛋白酶体抑制剂,并通过体外蛋白酶体活性抑制实验评价该类化合物的活性。结果 共合成了8个具有全新结构的二肽和三肽化合物,其结构经1H-NMR、ESI-MS确证,该类化合物对蛋白酶体具有中等的抑制活性。结论 肽链的长短及氨基末端不同的取代基对化合物的蛋白酶体抑制活性都有影响,8个化合物在体外对蛋白酶体都具有不同程度的抑制活性。本研究丰富了蛋白酶体抑制剂的结构类型,为该类化合物的深入研究奠定了基础。
关键词:蛋白酶体抑制剂;拟肽;非共价结合;合成;活性评价
泛素-蛋白酶体系统是生物体内蛋白质降解的主要途径,控制着细胞内>80%蛋白质的降解[1]。该降解途径主要包括靶蛋白的多泛素化标记和被蛋白酶体识别并特异性降解这2个过程[2]。在这个蛋白质降解通路中,蛋白酶体作为拥有 3种蛋白质水解活性的“降解工厂”,是该通路中最重要的一环。研究表明[3-6],蛋白酶体与细胞周期、基因转录、细胞凋亡以及机体的多种重要生理功能密切相关,其功能正常与否和包括肿瘤在内的多种疾病息息相关。因此,影响蛋白酶体功能来阻滞肿瘤发展的进程已成为肿瘤治疗的一个重要策略,蛋白酶体抑制剂已成为一种重要的肿瘤治疗药物。
随着Ixazomib(化合物1,结构见图1)在2015年底被FDA批准用于多发性骨髓瘤的治疗,蛋白酶体抑制剂的发展又向前迈进了一步。到目前为止,除Ixazomib外,获批上市的蛋白酶体抑制剂还有Bortezomib和Carfilzomib(化合物2和3,结构见图1)[7]。但这3个药物都属于共价结合抑制剂,通过其羧基末端的亲电基团与蛋白酶体上的苏氨酸残基形成共价键,从而发挥强效抑制活性。但是其高反应活性也使得特异性和稳定性降低,并且共价结合抑制剂多为不可逆抑制剂,不良反应大;而非共价结合型抑制剂通过氢键与蛋白酶体活性位点结合,能够与蛋白酶体较快地结合、分离,从而具有更广的组织分布特性和更小的不良反应。研究报道[8],羧基末端与苄胺结合的化合物以非共价结合方式与蛋白酶体作用,但却保留了较高的蛋白酶体抑制活性(化合物 4,结构见图1)。基于此,笔者根据先导化合物4的结构,选取优势片段邻氯苄胺作为羧基末端基团,同时,在短肽骨架中引入六元环的非肽片段,以增强肽类化合物对多种肽酶及蛋白酶的稳定性,设计合成了一系列含有六元环的拟肽衍生物,合成路线和目标化合物的结构图见图2~3。

图1 已上市及代表性非共价结合蛋白酶体抑制剂的结构式
Fig. 1 Structures of the approved (1, 2 and 3) and representative non-covalent (4) proteasome inhibitors
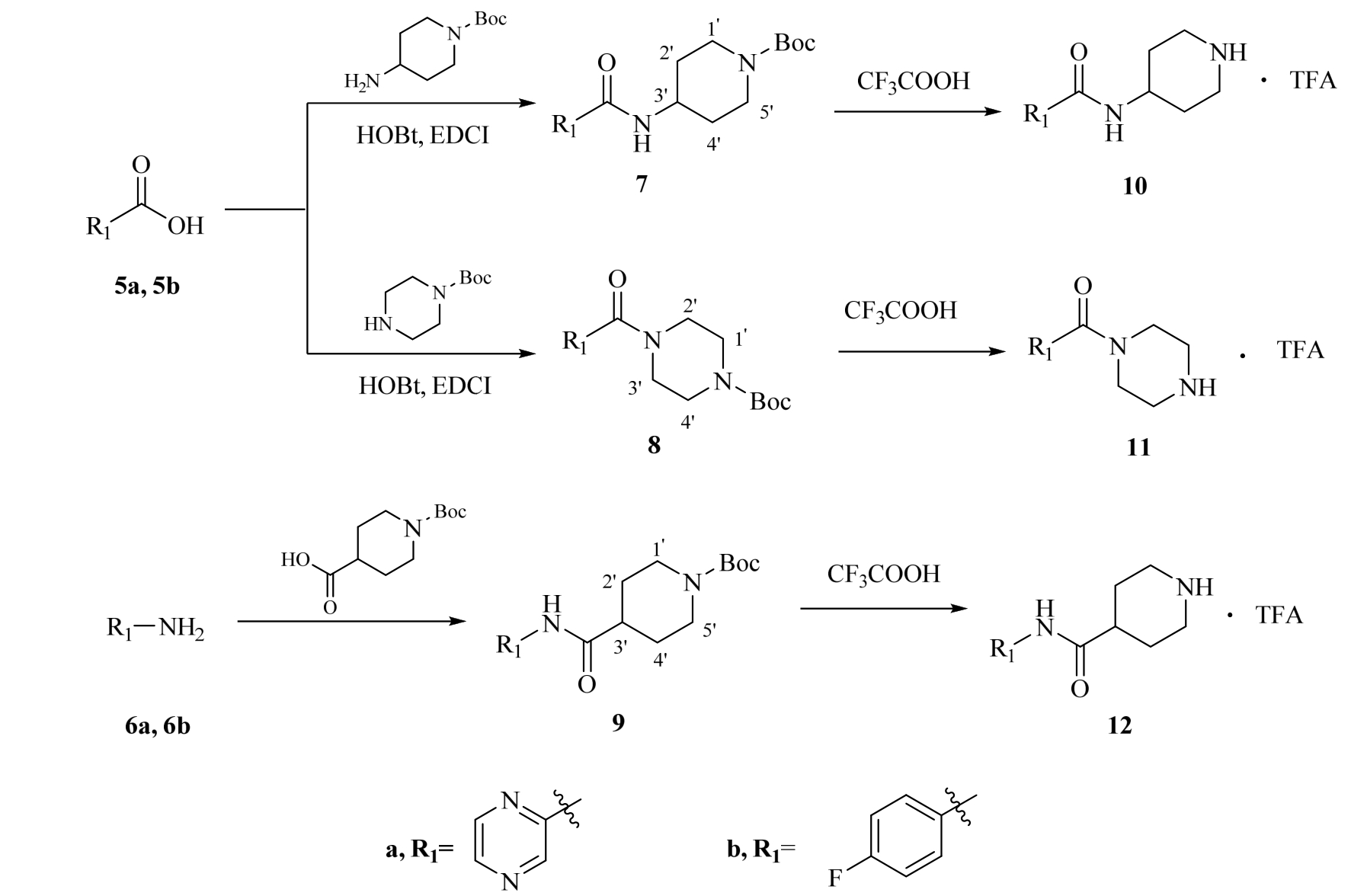
图2 中间体10、11及12的合成路线
Fig. 2 Synthetic routes of the intermediates 10, 11 and 12

图3 目标化合物合成路线及结构
Fig. 3 Synthetic routes and structures of the target compounds
Brüker Avancenmx-500型核磁仪、Esquire-LC-00075 型质谱仪(美国 Brüker公司);Nanodrop 1000紫外分光光度计(美国Thermo Scientific公司);薄层色谱硅胶GF254、硅胶H均为青岛海洋化工有限公司生产;其余试剂均为分析纯。
2.1 化合物7和8的合成
2.1.1N-(N’-Boc-4-哌啶基)吡嗪甲酰胺(7a) 吡嗪-2-羧酸(5a, 12 mmol,1.49 g)溶于 50 mL 二氯甲烷,加入 HOBt(12 mmol,1.62 g)和 EDCI(18 mmol,3.46 g),室温反应30 min。随即将N-Boc-4-氨基哌啶(10 mmol,2.0 g)和N,N-二异丙基乙胺(12 mmol,2.1 mL)加入反应液,室温反应2 h。加入50 mL饱和碳酸氢钠稀释,分出有机层,饱和食盐水(50 mL×1)洗,无水硫酸钠干燥,减压回收溶剂,柱层析分离得到2.6 g白色固体7a(石油醚∶乙酸乙酯=1∶1),采用同样方法得到化合物 7b,8a,8b。收率 85%;1H-NMR(500 MHz, CDCl3):δ:9.40(s,1H, pyrazine-H),8.75(d,1H,J=2.0 Hz,pyrazine-H),8.52(d,1H,J=2.0 Hz,pyrazine-H),7.72(d,1H,J=10.0 Hz,NH),4.17~4.07(m,3H,H-3’,H-1’a,H-5’a),2.95(t,2H,J=10.0 Hz,H-1’b,H-5’b),2.00(d,2H,J=15.0 Hz,H-2’a,H-4’a),1.52~1.46(m,11H,H-2’b,H-4’b,3CH3);ESI-MS:m/z=328.9[M+Na]+。
2.1.2N-(N’-Boc-4-哌啶基)-4-氟苯甲酰胺(7b)白色固体;收率86%;1H-NMR(500 MHz,CDCl3):δ:7.79~7.76(m,2H,Ar-H),7.10~7.09(m,2H,Ar-H),6.09(d,1H,J=7.5 Hz,NH),4.15~4.09(m,3H,H-3’,H-1’a,H-5’a),2.89(brs,2H,H-1’b,H-5’b),2.01(d,2H,J=11.0 Hz,H-2’a,H-4’a),1.46(s,9H,3CH3),1.42~1.39(m,2H,H-2’b,H-4’b);ESI-MS:m/z=345.0[M+Na]+。
2.1.3N-Boc-N’-吡嗪甲酰基哌嗪(8a) 白色固体;收率:83%;1H-NMR(500 MHz,CDCl3):δ:8.97 (d,1H,J=2.0 Hz,pyrazine-H),8.65(d,1H,J=2.0 Hz,pyrazine-H),8.54 (s,1H,pyrazine-H),3.79(t,2H,J=5.0 Hz,H-1’a,H-4’a),3.62(t,2H,J=5.0 Hz,H-2’a,H-3’a),3.56(t,2H,J=5.0 Hz,H-1’b,H-4’b),3.49(t,2H,J=5.0 Hz,H-2’b,H-3’b),1.47(s,9H,3CH3);ESI-MS:m/z=314.9[M+Na]+。
2.1.4N-Boc-N’-(4-氟苯甲酰基)哌嗪(8b) 白色固体;收率:97%;1H-NMR(500 MHz,CDCl3):δ:7.44~7.41(m,2H,Ar-H),7.13-7.10(m,2H,Ar-H),3.65~3.47(m,8H,H-1’a,H-1’b,H-2’a,H-2’b,H-3’a,H-3’b,H-4’a,H-4’b),1.48(s,9H,3CH3),ESI-MS:m/z=330.9[M+Na]+。
2.2 化合物9的合成
2.2.1N-吡 嗪 基 -N’-Boc-哌 啶 -4-甲 酰 胺 (9a)N-Boc-哌啶-4-甲酸(16 mmol,3.65 g)置于 50 mL三颈瓶中,N2保护下加入32 mL二氯甲烷,然后缓缓滴入吡啶(40 mmol,3.4 mL)和二氯亚砜(19.3 mmol,1.5 mL),室温反应0.5 h。随后,2-氨基吡嗪(6a,18.4 mmol,1.75 g)、三乙胺(56 mmol,8 mL)及催化量4-二甲氨基吡啶溶于二氯甲烷后逐滴加入到上述反应液中,室温反应6 h。反应液分别用 1 mmol·L-1盐酸(50 mL×1)和饱和碳酸氢钠(50 mL×1)洗,无水硫酸钠干燥,减压回收溶剂,柱层析分离得到4 g白色固体9a(石油醚∶乙酸乙酯=3∶2),收率 82%;采用同样方法得到化合物9b;1H-NMR(500 MHz,CDCl3):δ:9.55(s,1H,pyrazine-H),8.35(d,1H,J=2.0 Hz,pyrazine-H),8.23(s,1H,pyrazine-H),7.97(brs,1H,NH),4.20(brs,2H,H-1’a,H-5’a),2.88~2.79(m,2H,H-1’b,H-5’b),2.45-2.50(m,1H,H-3’),1.93(d,2H,J=7.5 Hz,H-2’a,H-4’a),1.79~1.71(m,2H,H-2’b,H-4’b),1.47(s,9H,3CH3);ESI-MS:m/z=328.9[M+Na]+。
2.2.2N-(4-氟苯基)-N’-Boc-哌啶-4-甲酰胺(9b)白色固体;收率75%;1H-NMR(500 MHz,CDCl3):δ:7.48~7.47(m,2H,Ar-H),7.20(s,1H,NH),7.03~7.00(m,2H,Ar-H),4.18(d,2H,J=12.5 Hz,H-1’a,H-5’a),2.80(t,2H,J=7.5 Hz,H-1’b,H-5’b),2.39~2.35(m,1H,H-3’),1.90(d,2H,J=12.0 Hz,H-2’a,H-4’a),1.77~1.71(m,2H,H-2’b,H-4’b),1.47(s,9H,3CH3);ESI-MS:m/z=344.9[M+Na]+。
2.3 化合物10,11 和12的合成
化合物7,8和9(10 mmol)分别溶于40 mL二氯甲烷中,逐滴加入20 mL三氟乙酸,室温反应1 h。减压蒸除溶剂,加入50 mL乙醚,析出白色固体,过滤、干燥得到相应产物10,11和12。该产物不经进一步纯化直接用于下一步反应。
2.4N-Boc-亮氨酸-2-氯苄胺的合成(14)
N-Boc-(L)-亮氨酸(6 mmol,1.39 g)溶于 25 mL二氯甲烷,加入 HOBt(6 mmol,0.81 g)和 EDCI(9 mmol,1.73 g),室温反应30 min。随即将邻氯苄胺(13,5 mmol,0.6 mL)和N,N-二异丙基乙胺(6 mmol,1 mL)加入反应液,室温反应2 h。加入30 mL饱和碳酸氢钠稀释,分出有机层,饱和食盐水(30 mL×1)洗,无水硫酸钠干燥,减压回收溶剂,柱层析分离得到1.51 g白色固体14(石油醚∶乙酸乙酯=8∶1),收率 85%;1H-NMR(500 MHz,CDCl3):δ: 7.36~7.33(m,2H,Ar-H),7.23~7.20(m,2H,Ar-H),6.68(s,1H,NH),4.91(d,1H,J=7.5 Hz,NH),4.52(t,2H,J=6.0 Hz,H-1’),4.13(s,1H,H-2’),1.72~1.64(m,2H,H-3’),1.50~1.41(m,10H,3CH3,H-4’),0.95~0.91(m,6H,2CH3);ESI-MS:m/z=376.9[M+Na]+。
2.5亮氨酸-2-氯苄胺三氟乙酸盐的合成(15)
N-Boc-亮氨酸-2-氯苄胺(14,10 mmol,3.55 g)溶于40 mL二氯甲烷,逐滴加入20 mL三氟乙酸。室温反应1 h,减压蒸除溶剂,加入50 mL乙醚,析出白色固体,过滤、干燥得到粗品 15。该粗品不经进一步纯化直接用于下一步反应。
2.6N-Boc-苯丙氨酸-亮氨酸-2-氯苄胺的合成(16)
N-Boc-(L)-苯丙氨酸(6 mmol,1.59 g)溶于25 mL二氯甲烷,加入 HOBt(6 mmol,0.81 g)和EDCI(9 mmol,1.73 g),室温反应30 min。随即将亮氨酸-2-氯苄胺三氟乙酸盐(15,5 mmol,1.84 g)和N,N-二异丙基乙胺(6 mmol,1 mL)加入反应液,室温反应2 h。加入30 mL饱和碳酸氢钠稀释,分出有机层,饱和食盐水(30 mL×1)洗,无水硫酸钠干燥,减压回收溶剂,柱层析分离得到2.2 g白色固体 16(石油醚∶乙酸乙酯=3∶1),收率 88%;1H-NMR (500 MHz,CDCl3):δ:7.36~7.15 (m,9H,Ar-H),6.63(s,1H,NH),6.21(d,1H,J=7.5 Hz,NH),4.94~4.93(m,1H,NH),4.48~4.40(m,3H,H-1’,H-5’),4.32~4.30(m,1H,H-2’),3.09~3.01(m,2H,H-6’),1.50~1.42(m,3H,H-3’,H-4’),1.37(s,9H,3CH3),0.90~0.86(m,6H,2CH3);ESI-MS:m/z=501.8[M+H]+。
2.7 苯丙氨酸-亮氨酸-2-氯苄胺三氟乙酸盐的合成(17)
N-Boc-苯丙氨酸-亮氨酸-2-氯苄胺(16,10 mmol,5.02 g)溶于40 mL二氯甲烷,逐滴加入20 mL三氟乙酸。室温反应1 h,减压蒸除溶剂,加入50 mL乙醚,析出白色固体,过滤、干燥得到产物 17。该产物不经进一步纯化直接用于下一步反应。
2.8 化合物18的合成
2.8.1N-[4-(吡嗪-2-基甲酰胺基)哌啶-1-甲酰基]二肽(苯丙氨酸-亮氨酸)-2-氯苄胺(18a) 苯丙氨酸-亮氨酸-2-氯苄胺三氟乙酸盐(17,2.1 mmol,1.08 g)溶于5 mL二氯甲烷和5 mL饱和碳酸氢钠混合溶液,冰浴下加入三光气(0.7 mmol,0.21 g),反应15 min,分出有机层,水层用二氯甲烷(20 mL×2)洗,合并有机层,无水硫酸钠干燥,减压蒸干,得到异氰酸酯;化合物10a(1.5 mmol,0.48 g)溶于5 mL二氯甲烷,加入N,N-二异丙基乙胺(2.5 mmol,0.5 mL),然后将上述异氰酸酯用少量二氯甲烷溶解后加入到溶液中,室温反应 1 h。饱和氯化铵(30 mL×1)洗,无水硫酸钠干燥,减压回收溶剂,柱层析分离得到0.72 g白色固体18a(乙酸乙酯),采用同样方法得到化合物18b。收率76%;1H-NMR(500 MHz,CDCl3):δ:9.39(d,1H,J=2.0 Hz,pyrazine-H),8.76(d,1H,J=2.0 Hz,pyrazine-H),8.52~8.51(dd,1H,J=2.5,1.5 Hz,pyrazine-H),7.70(d,1H,J=8.5 Hz,NH),7.33~7.18(m,10H,Ar-H+NH),6.98(t,1H,J=6.0 Hz,NH),6.61(d,1H,J=9.0 Hz,NH),5.02(d,1H,J=6.0 Hz,NH),4.51~4.45(m,4H,H-1’a,H-5’a,H-11’a,H-11’b),4.14~4.05(m,1H,H-3’),3.79~3.70(m,2H,H-1’b,H-5’b),3.15(dd,1H,J=6.5,12.5 Hz,H-7’a),3.01(dd,1H,J=6.5,12.5 Hz,H-7’b),2.94~2.82(m,2H,H-6’,H-8’),1.96~1.92(m,2H,H-2’a,H-4’a),1.59~1.24(m,5H,H-9’a,H-9’b,H-2’b,H-4’b,H-10’),0.92~0.88(m,6H,2CH3);ESI-MS:m/z=633.8[M+H]+.
2.8.2N-[4-(4-氟苯基甲酰胺基)哌啶-1-甲酰基]二肽(苯丙氨酸-亮氨酸)-2-氯苄胺(18b) 白色固体;收率 62%。1H-NMR(500 MHz,CDCl3):δ:7.78~7.75(m,2H,Ar-H),7.34~7.32(m,1H,Ar-H),7.29~7.27(m,2H,Ar-H),7.25~7.18(m,6H,Ar-H),7.08(m,2H,Ar-H),6.91(t,1H,J=5.5 Hz,NH),6.55(d,1H,J=8.0 Hz,NH),6.21(d,1H,J=3.0 Hz,NH),4.96(d,1H,J=6.0 Hz,NH),4.49~4.41(m,4H,H-1’a,H-5’a,H-11’a,H-11’b),4.15~4.05(m,1H,H-3’),3.78~3.72(m,2H,H-1’b,H-5’b),3.16(dd,1H,J=6.5,12.5 Hz,H-7’a),3.02(dd,1H,J=6.5,12.5 Hz,H-7’b),2.87~2.82(m,2H,H-6’,H-8’),1.98~1.91(m,2H,H-2’a,H-4’a),1.77-1.73(m,1H,H-10’),1.58~1.47(m,2H,H-2’b,H-4’b),1.29-1.20(m,2H,H-9’a,H-9’b),0.90(t,6H,J=10.0 Hz,2CH3);ESI-MS:m/z=649.8[M+H]+。
2.9N-Boc-亮氨酸-苯丙氨酸-亮氨酸-2-氯苄胺的合成(19)
N-Boc-(L)-亮氨酸(6 mmol,1.4 g)溶于 25 mL二氯甲烷,加入 HOBt(6 mmol,0.81 g)和 EDCI(9 mmol,1.73 g),室温反应30 min。随即将苯丙氨酸-亮氨酸-2-氯苄胺三氟乙酸盐(17,5 mmol,2.6 g)和N,N-二异丙基乙胺(6 mmol,1 mL)加入反应液,室温反应2 h。加入30 mL饱和碳酸氢钠稀释,分出有机层,饱和食盐水(30 mL×1)洗,无水硫酸钠干燥,减压回收溶剂,柱层析分离得到2.7 g白色固体19(石油醚∶乙酸乙酯=2∶1),收率88%。1H NMR (500 MHz,CDCl3):δ:7.33~7.27(m,5H,Ar-H+NH),7.25~7.12(m,6H,Ar-H),6.92(brs,1H,Ar-H),6.66 (s,1H,J=15.5 Hz,NH),4.80 (d,1H,J=15.5 Hz,CH2),4.66~4.54(m,3H,CH2+CH),4.45(dd,1H,J=16.0,6.0 Hz,CH),3.77(m,1H,CH),3.31~3.28(m,1H,CH),3.04~3.00(m,1H,CH),1.89~1.84(m,1H,CH2),1.69~1.43(m,5H,2CH2+CH),1.32(s,9H,3CH3),0.94~0.84(m,12H,4CH3);ESI-MS:m/z=614.9[M+H]+。
2.10 亮氨酸-苯丙氨酸-亮氨酸-2-氯苄胺三氟乙酸盐的合成(20)
N-Boc-亮氨酸-苯丙氨酸-亮氨酸-2-氯苄胺(19,10 mmol)溶于 40 mL二氯甲烷,逐滴加入20 mL三氟乙酸。室温反应1 h,减压蒸除溶剂,加入50 mL乙醚,析出白色固体,过滤、干燥得到产物 20。该产物不经进一步纯化直接用于下一步反应。
2.11 化合物21a~f的合成
2.1 1.1N-[4-(吡嗪-2-基甲酰胺基)哌啶-1-甲酰基]三肽(亮氨酸-苯丙氨酸-亮氨酸)-2-氯苄胺(21a)亮氨酸-苯丙氨酸-亮氨酸-2-氯苄胺三氟乙酸盐(20,2.1 mmol,1.32 g)溶于 5 mL二氯甲烷和 5 mL饱和碳酸氢钠混合溶液,冰浴下加入三光气(0.7 mmol,0.21 g),冰浴反应15 min,分出有机层,水层用二氯甲烷(20 mL×2)洗,合并有机层,无水硫酸钠干燥,减压蒸干,得到异氰酸酯;化合物10a(1.5 mmol,0.48 g)溶于5 mL二氯甲烷,加入N,N-二异丙基乙胺(2.5 mmol,0.5 mL),然后将上述异氰酸酯用少量二氯甲烷溶解后加入到溶液中,室温反应1 h。饱和氯化铵(30 mL×1)洗,无水硫酸钠干燥,减压回收溶剂,柱层析分离得到0.72 g白色固体21a(二氯甲烷∶甲醇=40∶1),采用同样方法得到化合物:21b~f。收率 66%;1H-NMR (500 MHz,d6-DMSO):δ:9.18(d,1H,J=2.0 Hz,pyrazine-H),8.87(d,1H,J=2.0 Hz,pyrazine-H),8.79(d,1H,J=8.0 Hz ,NH),8.73(m,1H,pyrazine-H),8.19(t,1H,J=5.5 Hz,NH),8.01(d,1H,J=8.0 Hz,NH),7.83(d,1H,J=7.5 Hz,NH),7.45~7.42(m,1H,Ar-H),7.32~7.28(m,3H,Ar-H),7.25~7.17(m,5H,Ar-H),6.53(d,1H,J=7.0 Hz,NH),4.50~4.46(m,1H,H-9’),4.38~4.27(m , 3H , H-14’a, H-14’b , H-6’),4.04~3.96(m,4H,H-11’,H-3’,H-1’a,H-5’a),3.05 (dd,1H,J=14.0,4.5 Hz,H-10’a),2.91(dd,1H,J=14.0,4.5 Hz,H-10’b),2.84~2.73(m,2H,H-1’b,H-5’b),1.76~1.73(m,2H,H-2’a,H-4’a),1.62~1.28(m,8H,H-2’b,H-4’b,H-7’a,H-7’b,H-12’a,H-12’b,H-8’,H-13’),0.89-0.79(m,12H,4CH3);ESI-MS:m/z=746.8[M+H]+。
2.1 1.2N-[4-(4-氟苯基甲酰胺基)哌啶-1-甲酰基]三肽(亮氨酸-苯丙氨酸-亮氨酸)-2-氯苄胺(21b)白色固体;收率 53.5%;1H-NMR (500 MHz,CDCl3):δ:8.32(d,1H,J=8.5 Hz,NH),8.23(t,1H,J=5.5 Hz,NH),8.02(d,1H,J=8.0 Hz,NH),7.94~7.90(m,2H,Ar-H),7.88~7.86(d,1H,J=8.0 Hz,NH),7.45~7.43(m,1H,Ar-H),7.33~7.22(m,5H,Ar-H),7.21~7.17(m,5H,Ar-H),6.54(d,1H,J=7.5 Hz,NH),4.50~4.46(m,1H,H-9’),4.38~4.27(m,3H,H-14’a,H-14’b,H-6’),4.05~3.92(m,4H,H-11’,H-3’,H-1’a,H-5’b),3.18(dd,1H,J=14.0,5.0 Hz,H-10’a),3.06(dd,1H,J=14.0,5.0 Hz,H-10’b),2.85~2.73(m,2H,H-1’a,H-1’b),1.78~1.76(brs,2H,H-2’a,H-4’a),1.53~1.23(m,8H,H-2’b,H-4’b,H-7’a,H-7’b,H-12’a,H-12’b,H-8’,H-13’),0.89~0.77(m,12H,4CH3);ESI-MS:m/z=762.7[M+H]+。
2.1 1.3N-[4-(吡嗪-2-甲酰基)哌嗪-1-甲酰基]三肽(亮氨酸-苯丙氨酸-亮氨酸)-2-氯苄胺(21c) 白色固体;收率 68.3%;1H-NMR (500 MHz,d6-DMSO):δ:8.86(d,1H,J=1.5 Hz,pyrazine-H),8.76(d,1H,J=1.5 Hz,pyrazine-H),8.69~8.68(m,1H,pyrazine-H),8.22(t,1H,J=6.0 Hz,NH),8.01(d,1H,J=8.0 Hz,NH),7.84(d,1H,J=8.0 Hz,NH),7.46~7.42(m,1H,Ar-H),7.32~7.27(m,3H,Ar-H),7.22~7.17(m,5H,Ar-H),6.61(d,1H,J=7.0 Hz,NH),4.53~4.46(m,1H,H-9’),4.39~4.27(m,3H,H-14’a,H-14’b,H-6’),4.08~4.02(m,1H,H-11’),3.64~3.61(m,2H,H-3’a,H-4’a),3.47~3.33(m,6H,H-3’b,H-4’b,H-1’a,H-1’b,H-2’a,H-2’b),3.04(dd,1H,J=5.0,14 Hz,H-10’a),2.88(dd,1H,J=5.0,14 Hz,H-10’b),1.57~1.33(m,6H,H-12’a,H-12’b,H-7’a,H-7’b,H-13’,H-8’),0.89~0.77(m,12H,4CH3);ESI-MS:m/z=732.8[M+H]+。
2.1 1.4N-[4-(4-氟苯甲酰基)哌嗪-1-甲酰基]三肽(亮氨酸-苯丙氨酸-亮氨酸)-2-氯苄胺(21d) 白色固体;收率 41.9%;1H-NMR (500 MHz,d6-DMSO):δ:8.23(t,1H,J=6.0 Hz,NH),8.00(d,1H,J=8.5 Hz,NH),7.85(d,1H,J=8.0 Hz,NH),7.51~7.48(m,2H,Ar-H),7.45~7.42(m,1H,Ar-H),7.31~7.28(m,5H,Ar-H),7.22~7.14 (m,5H,Ar-H),6.59(d,1H,J=7.5 Hz,NH),4.51~4.46(m,1H,H-9’),4.34~4.26(m,3H,H-14’a,H-14’b,H-6’),4.07~4.03(m,1H,H-11’),3.56~3.34(m,8H,H-1’a,H-1’b,H-2’a,H-2’b,H-3’a,H-4’a,H-3’b,H-4’b),3.03(dd,1H,J=5.0,14 Hz,H-10’a),2.88(dd,1H,J=5.0,14 Hz,H-10’b),1.55~1.29 (m,6H,H-12’a,H-12’b,H-7’a,H-7’b,H-8’ ,H-13’),0.87~0.78(m,12H,4CH3);ESI-MS:m/z=748.7[M+H]+。
2.1 1.5N-[1-(吡嗪-2-基胺甲酰基)哌啶-1-甲酰基]三肽(亮氨酸-苯丙氨酸-亮氨酸)-2-氯苄胺(21e)白色固体;收率 43.8%;1H-NMR (500 MHz,d6-DMSO):δ:10.77(s,1H,NH),9.35(d,1H,J=1.5 Hz,pyrazine-H),8.39(m,1H,pyrazine-H),8.36(d,1H,J=1.5 Hz,pyrazine-H),8.17(t,1H,J=5.5 Hz,NH),7.98(d,1H,J=8.0 Hz,NH),7.83(d,1H,J=8.0 Hz,NH),7.45~7.43(m,1H,Ar-H),7.33~7.27(m,3H,Ar -H),7.25~7.17(m,5H,Ar-H),6.51(d,1H,J=7.0 Hz,NH),4.50~4.45(m,1H,H-9’),4.39~4.26(m,3H,H-14’a,H-14’b,H-6’),4.05~3.99(m,3H,H-1’a,H-5’a,H-11’),3.05(dd,1H,J=5.0,14 Hz,H-10’a),2.92(dd,1H,J=5.0,14 Hz,H-10’b),2.74~2.64(m,3H,H-1’b,H-5’b,H-3’),1.79(d,2H,J=11.5 Hz,H-2’a,H-4’a),1.57~1.30(m,8H,H-2’b,H-4’b,H-12’a,H-12’b,H-7’a,H-7’b,H-13’,H-8’),0.91~0.78(m,12H,4CH3);ESI-MS:m/z=746.8[M+H]+。
2.1 1.6N-[1-4-(氟苯基胺甲酰基)哌啶-4-甲酰基]三肽(亮氨酸-苯丙氨酸-亮氨酸)-2-氯苄胺(21f)白色固体;收率 45%;1H-NMR (500 MHz,d6-DMSO):δ:9.95(s,1H,NH),8.17(t,1H,J=6.0 Hz,NH),7.98(d,1H,J=8.5 Hz,NH),7.83(d,1H,J=8.0 Hz,NH),7.63~7.60(m,2H,Ar-H),7.44~7.42(m,1H,Ar-H),7.33~7.29(m,3H,Ar-H),7.29~7.16(m,5H,Ar-H),7.16~7.11(m,2H,Ar-H),6.51(d,1H,J=7.0 Hz,NH),4.50~4.45(m,1H,H-9’),4.39~4.26(m,3H,H-14’a,H-14’b,H-6’),4.06~3.98(m,3H,H-1’a,H-5’a,H-11’),3.04(dd,1H,J=5.0,14 Hz,H-10’a),2.92(dd,1H,J=5.0,14 Hz,H-10’b),2.76~2.68(m,2H,H-1’b,H-5’b),2.49~2.46(m,1H,H-3’),1.75~1.73(m,2H,H-2’a,H-4’a),1.57~1.30(m,8H,H-2’b,H-4’b,H-12’a,H-12’b,H-7’a,H-7’b,H-8’,H-13’),0.90~0.75(m,12H,4CH3);ESI-MS:m/z=762.7[M+H]+。
将1 μL蛋白酶体抑制剂(Carfilzomib 为阳性药物)加入 10 μL 纯化的蛋白酶体(5 μg·mL-1)中,孵育 15 min。再加入 39 μL蛋白酶体底物:37.5 μmol·L-1Suc-Leu-Leu-Val-Tyr-AMC。蛋白酶体水解底物中的Tyr-AMC 序列,释放出 AMC,在激发光 355 nm和发射光 460 nm 的条件下可以检测到水解后产物 AMC 的荧光吸收值,观察化合物对酶活性的抑制情况。所有实验在相同条件下均重复进行 3 次,结果见表1。
表1 目标化合物对蛋白酶体的抑制活性(x±s)
Tab.1 Proteasome inhibitory activities of the target compounds (x±s) μmol·L-1

从上述活性测试结果可见,合成的 8个目标化合物在体外对蛋白酶体具有不同程度的抑制活性。比较目标化合物结构可以发现,肽链的长短对活性有明显的影响:二肽化合物 18a、18b(<1 μmol·L-1)对蛋白酶体的抑制活性较三肽化合物 21a~f (>2 μmol·L-1)好。此外,氨基末端的不同取代基(R1)对活性也有影响:吡嗪-2-基取代较对氟苯基取代更有利于提高活性,吡嗪-2-基取代的化合物18a、21a、21c和21e的活性均优于相应的对氟苯基取代的化合物18b、21b、21d和21f,这种差别可能是因为吡嗪-2-基上的 2个氮原子可以与蛋白酶体形成更多的氢键结合作用。虽然目标化合物对蛋白酶体的抑制活性与阳性对照药物Carfilzomib相比还存在一定差距,但是作为开发短肽非共价结合类蛋白酶体抑制剂的探索工作,也为后续研究活性更好、更具类药性的此类化合物提供了思路。
[1] ZHANG J K, ZHUANG R X, HU Y Z. Synthesis, biological evaluation of novelβ-peptidyl epoxyketone proteasome inhibitors [J]. Chin J Mod Appl Pharm(中国现代应用药学),2015, 32(11): 1329-1336.
[2] SHEN M, SCHMITT S, BUAC D, et al. Targeting the ubiquitin proteasome system for cancer therapy [J]. Exp Opin Ther Targets, 2013, 17(9): 1091-1108.
[3] MICALE N, SCARBACI K, TROIANO V, et al.Peptide-based proteasome inhibitors in anticancer drug design[J]. Med Res Rev, 2014, 34(5): 1001-1069.
[4] MOREAU P, RICHARD P G, CAVO M, et al. Proteasome inhibitors in multiple myeloma: 10 years later [J]. Blood, 2012,120(5): 947-959.
[5] PORTBURY A L, RONNEBAUM S M, ZUNGU M, et al.Back to your heart: ubiquitin proteasome system-regulated signal transduction [J]. J Mol Cell Cardiol, 2012, 52(3):526-537.
[6] FRANKLAND S S, BHAUMIK S R. The 26S proteasome complex: an attractive target for cancer therapy [J]. Biochim Biophys Acta, 2012, 1825(1): 64-76.
[7] KONG L M, SUN H Z, ZHANG X G. Research progress of epoxyketone peptidyl proteasome inhibitors [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2015, 32(12): 1525-1530.
[8] CHRISTOPHER BLACKBURN, KENNETH M, et al.Characterization of a new series of non-covalent proteasome inhibitors with exquisite potency and selectivity for the 20Sβ5-subunit [J]. Biochem J, 2010, 430(3): 461-476.
Synthesis and Biological Evaluation of Novel Non-covalent Peptidomimetic Proteasome Inhibitors
XI Jianjun, ZHANG Jiankang*, ZHAO Yanmei, HE Ruoyu, ZHUANG Rangxiao, PAN Jinming, HUANG Weiwei, LIU Shourong*
(Xixi Hospital of Hangzhou, Hangzhou 310023, China)
ABSTRACT:OBJECTIVE To design and synthesize a series of non-covalent peptidomimetic proteasome inhibitors, and to evaluate their enzymatic activities. METHODS A series of non-covalent short peptidyl proteasome inhibitors were designed and synthesized with rational drug design strategies such as bioisostere and amino acid replacement based on the binding modes of the non-covalent proteasome inhibitors with the proteasome. 2-Chloride benzyl amine was selected as the carboxyl terminal group, and a six-membered ring was introduced into the peptide skeleton to increase the compounds’ stability. All the target compounds were tested for their enzymatic inhibitory activitiesin vitro. RESULTS Totally 8 novel di- and tripeptidyl analogues were synthesized, which were confirmed by1H-NMR and ESI-MS. These target compounds exhibited moderate proteasome inhibitory activities. CONCLUSION The proteasome inhibitory activities of the target compounds are influenced by the length of the peptides and various amino terminal substituents. All the 8 compounds display different degree of proteasome inhibitory activitiesin vitro. In a word, this study develops series of proteasome inhibitors with new structure type,which will be helpful for the further development of this series of compounds.
KEY WORDS:proteasome inhibitors; peptidomimetic; non-covalent binding; synthesis; biological evaluation
REFERENCES
中图分类号:R914.5
文献标志码:B
文章编号:1007-7693(2017)10-1401-08
DOI:10.13748/j.cnki.issn1007-7693.2017.10.009
引用本文:席建军, 张建康, 赵艳梅, 等. 新型非共价结合拟肽类蛋白酶体抑制剂的合成及活性评价[J]. 中国现代应用药学, 2017, 34(10): 1401-1408.
基金项目:杭州市重大科技创新项目(20152013A03);杭州市科技计划项目(20150733Q49)
作者简介:席建军,男,硕士,主管药师 Tel: (0571)86481960 E-mail: 360550573@qq.com*
通信作者:张建康,男,博士,主管药师 Tel: (0571)86481960 E-mail: zjk0125@yeah.net 刘寿荣,男,硕士,主任医师 Tel: (0571)86481960 E-mail: lsr85463990@sina.com
收稿日期:2017-02-07
(本文责编:曹粤锋)